10. Sınıf Kimya Ders Kitabı Sayfa 116-147 Cevapları Meb Yayınları

 126
126
10. Sınıf Kimya Ders Kitabı Sayfa 116 Cevapları
1. Soru - Sütün yapısında meydana gelen bu değişimlerden gözlemlenebilir olanlar nelerdir?
- Sütün tat ve kokusunun değişmesi
- Sütün ısıtıldığında renginin kahverengiye dönmesi
- Sütün bozulması sonucu çökelek oluşması
- Sütün renginin sarımsı-yeşile dönüşmesi
2. Soru - Metinde okuduğu kimyasal değişimleri gözlemlemek isteyen bir öğrenci aşağıdaki düzenekleri kuruyor. Her iki düzenekte yapılan gözlemler sonucunda, kimyasal değişimi gösteren hangi veriler elde edilebilir?
| Tepkime | Gaz çıkışı | Renk değişimi | Koku | Katı oluşumu | Diğer |
|---|---|---|---|---|---|
| 1. düzenek | √ | √ | √ | √ | |
| 2. düzenek | √ | √ | √ |
 226
226
10. Sınıf Kimya Ders Kitabı Cevapları MEB Yayınları Sayfa 117
3. Soru Metinde geçen kimyasal değişimlerden üç tanesi aşağıda modellenmiştir. Modellerden yola çıkarak kimyasal değişimin göstergelerini alt mikro seviyedeki değişim temelinde açıklayınız.
Cevap: Kimyasal değişimlerde atomlar arasındaki bağlar kopar ve yeni bağlar oluşur. Bu süreçte yeni maddeler meydana gelir. Maddenin rengi, kokusu, tadı ve hatta fiziksel hâli değişebilir.
Sütte gerçekleşen reaksiyonlarda, laktaz enzimi laktozu glikoza, bakteriler ise glikozu laktik aside dönüştürür. Bu süreç sonunda çökelek (katı oluşumu) ve koku değişimi gibi gözle görülür değişiklikler meydana gelir.
4. Soru - Sütün yapısında meydana gelen değişimlerden yola çıkılarak aşağıdaki bilgilerden hangisine ulaşılamaz?
Cevap: C) Isıtma işlemi sütün yapısını değil sadece dış görünüşünü değiştirir.
Açıklama: Isıtma işlemi yalnızca görünüşü değil, sütün kimyasal yapısını da değiştirir. Bu nedenle C şıkkı yanlış bilgidir.
 326
326
10. Sınıf Kimya Ders Kitabı Cevapları MEB Yayınları Sayfa 118
5. Soru - Metinde geçen tepkimelerden yola çıkarak aşağıdaki deneylerde kimyasal değişimlerin gözlemlenebilir göstergelerini yazınız.
| Deney | Gözlem | Tepkimenin Göstergesi |
|---|---|---|
| 1. Magnezyum zımparalandıktan sonra yakıldı. | Parlak beyaz ışık vererek yanar, geriye beyaz bir kül kalır. | Isı ve ışık yayılması |
| 2. Magnezyum yakıldıktan sonra kalan küle su eklendi. | Kırmızı turnusol kâğıdı maviye döner. | pH değişimi |
| 3. Magnezyum oksijensiz ortamda karbon dioksit ile yakıldı. | Beyaz toz (MgO) ve siyah karbon is oluşur. | Katı oluşumu ve renk değişimi |
| 4. Sıcak suya katı magnezyum eklendi. | Magnezyum hidroksit katısı ve hidrojen gazı oluşur. | Gaz çıkışı ve katı oluşumu |
6. Soru - Magnezyum metalinin CO₂ bileşiği ile tepkimesi:
2Mg(s) + CO₂(g) → 2MgO(s) + C(s)
Açıklama:
- Başlangıçta: Magnezyum metalik yapıda serbest atomlardan oluşur. Karbon dioksit ise C=O çift bağları içeren doğrusal bir moleküldür.
- Tepkime sırasında: C=O bağları kırılır, Mg–O bağları oluşur.
- Sonuç: Beyaz renkli magnezyum oksit (MgO) ve siyah renkli karbon (C) meydana gelir.
- Gözlemlenebilir değişimler: Parlak beyaz ışık, ısı açığa çıkması, renk değişimi ve katı oluşumudur.
Şekil Açıklaması:
- Solda serbest Mg atomları ve CO₂ molekülleri,
- Ok yönünde tepkime sonucu sağda MgO bileşiği ve serbest C atomları oluşur.
7. Soru - Magnezyum yangınlarında karbon dioksit veya su kullanmanın tehlikeleri nelerdir?
Cevap: Magnezyum, su (H₂O) ve karbon dioksit (CO₂) ile kimyasal tepkimeye girer.
- Su ile tepkimesinde hidrojen gazı açığa çıkar. Bu gaz yanıcıdır ve yangının büyümesine neden olur.
- Karbon dioksit ile tepkimesinde karbon ve magnezyum oksit oluşurken yüksek ısı açığa çıkar, bu da yangını söndürmek yerine artırır.
Sonuç: Bu nedenle magnezyum yangınlarında CO₂’li veya su bazlı söndürücüler kullanılmaz. Bunun yerine kum, toz söndürücü veya özel metal yangın söndürme tozları tercih edilmelidir.
 426
426
10. Sınıf Kimya Ders Kitabı Cevapları – Sayfa 119 (MEB Yayınları)
8. Soru - Magnezyum şeridinin yanması sırasında aşağıdaki gözlemlerden hangisi bu olayın bir kimyasal tepkime olduğunun kanıtı olamaz?
Cevap: E) Magnezyum şeridinin şekil değişikliğine uğraması
Açıklama: Magnezyumun şekil değiştirmesi yalnızca fiziksel bir değişimdir.
Diğer gözlemler (ısı, ışık, katı oluşumu, kütle farkı) kimyasal değişim göstergeleridir.
9. Soru - Karbon monoksidin oksijenle yanma tepkimesini en iyi temsil eden modeli aşağıdaki tablodan seçiniz.
Cevap: II. Model
Gerekçe: Tepkime denklemine göre:
2CO(g) + O₂(g) → 2CO₂(g)
Bu nedenle başlangıçta;
- CO molekülü: 1 karbon (gri) + 1 oksijen (kırmızı) atomundan oluşur.
- O₂ molekülü: 2 oksijen atomundan oluşur.
Tepkime sonucunda her bir karbon atomu, iki oksijenle birleşerek karbon dioksit (CO₂) oluşturur.
II. model, bu bağ değişimini ve ürün oluşumunu doğru biçimde göstermektedir.
 526
526
10. Sınıf Kimya Ders Kitabı Cevapları – Sayfa 120 (MEB Yayınları)
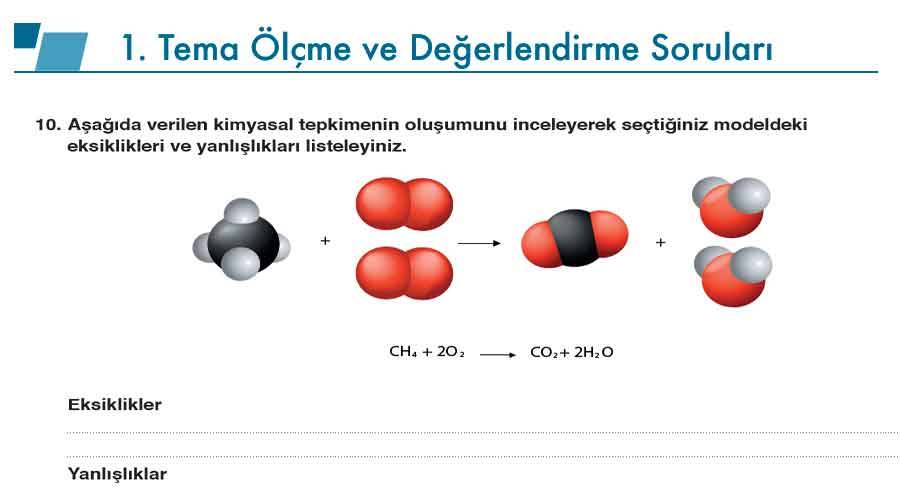
Soru 10: Aşağıda verilen kimyasal tepkimenin oluşumunu inceleyerek seçtiğiniz modeldeki eksiklikleri ve yanlışlıkları listeleyiniz.
Eksiklikler:
- Tepkimenin gerçekleşmesi için gereken ısı veya enerji gösterilmemiştir.
- Moleküllerin fiziksel hâlleri (gaz, sıvı) belirtilmemiştir.
- Bağ kırılma ve oluşum süreçleri mikro düzeyde gösterilmemiştir.
- Oksijen molekülündeki çift bağ açıkça belirtilmemiştir.
Yanlışlıklar:
- Tepkime denklemi tam olarak dengelenecek şekilde gösterilmemiştir.
- Bağların dönüşümü ve atomların yer değiştirmesi doğru çizilmemiştir.
- Oluşan ürünlerin molekül yapısı hatalı çizilmiştir.
Soru 11: CO(g) + O₂(g) → CO₂(g) tepkime denklemi ile ilgili aşağıdakilerden hangisi doğrudur?
Cevap: C) Tepkimenin uzay-dolgu modeli gösterimiyle bağ türü ve sayısı bulunabilir.
Açıklama: Uzay-dolgu modellerinde atomlar arasındaki bağ türü ve sayısı üç boyutlu olarak gösterilebilir. Bu nedenle doğru seçenek C şıkkıdır.
 626
626
10. Sınıf Kimya Ders Kitabı Cevapları – Sayfa 121 (MEB Yayınları)
Soru 12: Metinde geçen tepkimelerin gözlemlenebilir göstergeleri aşağıdakilerden hangisinde doğru şekilde sıralanmıştır?
Cevap: C) Katı oluşumu – pH değişimi – Gaz çıkışı
- tepkimede Mg(OH)₂ katısı oluşur (çökelme),
- tepkimede pH değişimi olur (asit-baz),
- tepkimede gaz çıkışı gözlenir (Cl₂).
Soru 13: Metinde geçen tepkimelerin türlerini belirleyiniz.
| Tepkime Türü | Açıklama |
|---|---|
| Çökelme tepkimesi | I. tepkime: Mg(OH)₂ oluşumu |
| Asit–baz tepkimesi | II. tepkime: Mg(OH)₂ + HCl → MgCl₂ + H₂O |
| İndirgenme–yükseltgenme tepkimesi | III. tepkime: MgCl₂ → Mg + Cl₂ |
Soru 14: Metinde geçen tepkimelerin alt mikro seviyedeki süreçlerini açıklayınız.
I. Tepkime (Çökelme): Mg²⁺ iyonları OH⁻ iyonlarıyla etkileşip iyonik bağ kurar, beyaz çökelti oluşur.
II. Tepkime (Asit–baz): H⁺ iyonları ile OH⁻ iyonları birleşerek H₂O molekülü oluşturur; çözeltinin pH’ı nötrleşir.
III. Tepkime (Redoks): Katotta Mg²⁺ iyonu indirgenerek metal Mg’a dönüşür, anotta Cl⁻ iyonları yükseltgenerek Cl₂ gazı çıkar.
 726
726
10. Sınıf Kimya Ders Kitabı Sayfa 122 Cevapları (MEB Yayınları)
Soru 15: Yukarıdaki boncuklarla yapılacak bir kolye için satın alınması gereken her bir boncuk miktarını hangi ölçü birimiyle ifade etmek daha uygun olur?
Cevap: Küçük boyutlu ve çok sayıda olan boncuklar gram (g) veya kilogram (kg) ile ifade edilmelidir.
Daha büyük boyutlu boncuklar ise adet (tane) olarak alınmalıdır.
Bu şekilde ölçüm daha doğru ve pratik olur.
Soru 16: Tablodaki boncuk sayısı 10 katına çıkarılsaydı bağıl kütle ve bağıl kütleye karşılık gelen tanecik sayısında nasıl bir değişim olurdu?
Cevap: Boncuk sayısı 10 katına çıkarıldığında, her tür boncuğun toplam kütlesi 10 kat artar.
Ancak bağıl kütle (karşılaştırmalı oran) ve bağıl kütleye karşılık gelen tanecik sayısı değişmez.
| Boncuk | Adet | Kütle (g) | Bağıl kütle (g) | Bağıl kütleye karşılık gelen tanecik sayısı |
|---|---|---|---|---|
| Bej | 1000 | 694,8 | 3,48 | 5 |
| Turuncu | 1000 | 196,6 | 1 | 5 |
| Pembe | 1000 | 415,6 | 2,08 | 5 |
Sonuç: Boncuk sayısı 10 katına çıksa da bağıl kütle oranı sabit kalır, çünkü tüm kütleler aynı oranda artar. Tanecik sayısı da değişmez.
 826
826
10. Sınıf Kimya Ders Kitabı Sayfa 123 Cevapları – MEB Yayınları
Soru 17 - Bir kap kısaca “1 K” olarak isimlendirildiğine göre 1 K biriminin tanımını yaparak içerdiği tanecik sayısını yazınız.
Cevap: 1 K, 5 tanecik içeren bir sayı birimidir.
Soru 18 - Elde ettiğiniz işlemleri mol kavramı ile ilişkilendirerek açıklayınız.
Cevap: K birimi, mol gibi birimdir. 1 mol = Nₐ tanecik, 1 K = 5 tanecik içerir.
Soru 19 - Elde ettiğiniz verilerden yola çıkarak aşağıdaki tabloyu tamamlayınız.
| Boncuk | Tanecik Sayısı |
|---|---|
| 4 K boncuk | 20 tane boncuk |
| 1,5 mol | 9,03·10²³ tanecik |
| 1 mol | 6,02·10²³ tanecik |
| 20 K boncuk | 100 tane boncuk |
Soru 20 - Su moleküllerinin kütlesi ile mol sayısı arasındaki ilişki nedir? Açıklayınız.
Cevap: Mol sayısı arttıkça kütle artar. İlişki formülü: m = n·M
 926
926
10. Sınıf Kimya Ders Kitabı Sayfa 124 Cevapları – MEB Yayınları
Soru 21 - Suyun mol kütlesinin doğru olup olmadığını nasıl test edersiniz?
Cevap: Her kütle, kendi mol sayısına bölünür. Sonuç 18 g/mol çıkarsa değer doğrudur.
Soru 22 - Grafikteki bilgilerden hangisi çıkarılamaz?
Cevap: C) 5 mol H₂O bileşiğinde 90 g oksijen, 10 g hidrojen bulunur.
Soru 23 - Tepkime tutarsızlığını belirlemek için hangi yöntem kullanılamaz?
Cevap: D) Molekül türü belirleme yöntemi kullanılamaz.
Soru 24 - Tepken ve ürünlerin tanecik sayıları arasındaki tutarsızlık nedir?
- CO + H₂ → CH₃OH: Tepkenlerde H₂, ürünlerde 4 H atomu → hidrojen sayısı farklı.
- CH₃OH + O₂ → CO₂ + H₂O: Tepkenlerde 4 H, ürünlerde 2 H → hidrojen eşit değil.
 1026
1026
10. Sınıf Kimya Ders Kitabı Sayfa 125 Cevapları – MEB Yayınları
Soru 25 - Tepkimelerdeki tutarsızlıkları gidermek için katsayılar ekleyiniz.
CO + 2H₂ → CH₃OH
CH₃OH + 3/2O₂ → CO₂ + 2H₂O
Soru 26 - Denkleştirdiğiniz tepkimelerde atom sayısını tabloya yazınız.
CO + 2H₂ → CH₃OH
| Atom Türü | Tepkenlerdeki Sayı | Ürünlerdeki Sayı |
|---|---|---|
| C | 1 | 1 |
| H | 4 | 4 |
| O | 1 | 1 |
CH₃OH + 3/2O₂ → CO₂ + 2H₂O
| Atom Türü | Tepkenlerdeki Sayı | Ürünlerdeki Sayı |
|---|---|---|
| C | 1 | 1 |
| H | 4 | 4 |
| O | 4 | 4 |
Değerlendirme: Her iki tepkime de denktir.
 1126
1126
10. Sınıf Kimya Ders Kitabı (MEB Yayınları) – Sayfa 126 Cevapları
Soru 27 : Denkleştirilmiş tepkimelerdeki ifadelerden hangisi yanlıştır?
Cevap: B) 2 mol saf altın elde etmek için 1 mol Zn tepkimeye girer.
Açıklama: Tepkime denkliğine göre 1 mol Zn, 2 mol Au elde edilmesi için yeterlidir.
Soru 28: 39,4 g altın için stokiyometrik ilişkiyi zihin haritası şeklinde gösteriniz.
Cevap: 39,4 g Au = 0,20 mol Au
→ 0,40 mol NaCN tepkimeye girer.
→ 0,05 mol O₂ ve 0,10 mol H₂O kullanılır.
→ 0,20 mol Na[Au(CN)₂], 0,20 mol NaOH ve 0,10 mol Zn oluşur.
Yorum: Hesaplamalar altın eldesi sürecindeki madde ilişkilerini gösterir.
Soru 29
a) Tepkimede kullanılan NaCN miktarı: 0,40 mol
b) Oluşan NaOH miktarı: 0,20 mol
c) 5 ton cevherden 39,4 g altın → 7,88 g/ton saflık derecesi
Açıklama: Altının saflığı, cevherdeki altın oranını gösterir.
Soru 30 - 18 ayar 10,5 g altın yüzük için kaç g NaCN gerekir?
Cevap: Saf altın = 10,5 × (18/24) = 7,875 g ≈ 0,04 mol Au
1 mol Au → 2 mol NaCN
0,04 mol Au → 0,08 mol NaCN
NaCN mol kütlesi = 49 g/mol
m = 0,08 × 49 = 3,92 g NaCN
Sonuç: 18 ayar 10,5 g’lık yüzük üretimi için yaklaşık 3,9 g NaCN gereklidir.
 1226
1226
10. Sınıf Kimya Ders Kitabı Sayfa 127 Cevapları – MEB Yayınları
Soru 31 : Verilen bilgilerden yola çıkarak gazların özellikleriyle ilgili aşağıdaki ifadelerden hangisi yanlıştır?
Cevap: E) Elastik balonlar dış basınçtan etkilenmez.
Açıklama: Balonlar dış basınç değişiminden etkilenir. Dış basınç artarsa balon büzülür, azalırsa genişler.
Soru 32 : Posterdeki örneklerden gazların özelliklerini belirleyerek tabloya yazınız.
| Örnek Numarası | Gazın Özelliği |
|---|---|
| 1 | Gazların yoğunluk farkı: He havadan hafiftir, balonlar yükselir. |
| 2 | Gaz basıncı azalınca CO₂ sıvıdan ayrılır, kabarcık oluşur. |
| 3 | Gazlar her oranda karışabilir (O₂ zenginleştirilmiş tüpler). |
| 4 | Gazlar sıkıştırılabilir, bu nedenle yangın tüpleri yüksek basınçla doldurulur. |
| 5 | Gazlar homojen dağılır, lastiklerde basınç eşit olur. |
| 6 | Gazların sıcaklıkla basıncı artar, bu yüzden propan tüpleri yüksek sıcaklıkta patlayabilir. |
 1326
1326
10. Sınıf Kimya Ders Kitabı Sayfa 128 Cevapları (MEB Yayınları)
Soru 33: Karbon dioksit 25 °C sıcaklıkta yaklaşık 67 atm basınçta sıkıştırılırsa sıvı karbon dioksit oluşur. Yangın tüpleri 20 °C sıcaklıkta ve 67 atm basınçta doldurulur. 30 °C’de tüp açıldığında gaz basıncı 1 atm’e düşer.
| Durum | Taneciklerin Görünümü | Nedeni |
|---|---|---|
| 20 °C ve 67 atm | Tanecikler birbirine çok yakın, yoğun ve düzensiz biçimde bulunur. (Sıvı hâl) | Basınç yüksek, tanecikler sıkıştırılmıştır. |
| 30 °C ve 1 atm | Tanecikler birbirinden uzak, boşluk fazladır, serbest hareket eder. (Gaz hâl) | Basınç azalmış, sıcaklık artmıştır, tanecikler uzaklaşır. |
Açıklama: Basınç azalınca tanecikler arası boşluk artar, sıcaklık artışıyla taneciklerin hareket enerjisi yükselir. Bu nedenle CO₂ sıvı hâlden gaz hâline geçer.
Soru 34 : Aşağıdaki şemada boş bırakılan yerlere gazların özellikleriyle ilgili uygun örnekler yazınız.
- Belirli şekil ve hacimleri yoktur: Gazlar kabın tamamını doldurur.
- Sıkıştırılabilir ve genleşebilir: Gazlar yüksek basınçta depolanabilir (yangın tüpü).
- Tanecikleri sürekli hareket halindedir: Gazlar her yöne yayılır.
- Basıncı her noktaya eşit iletir: Lastiklerde hava basıncı eşit dağılır.
- Her oranda karışabilir: Gazlar homojen karışımlar yapar (örnek: hava).
 1426
1426
10. Sınıf Kimya Ders Kitabı Sayfa 129-130 Cevapları (MEB Yayınları)
Sayfa 129
35. Soru : Gazların özellikleriyle ilgili basınç, hacim, sıcaklık ve madde miktarı arasındaki ilişkileri hipotez olarak belirtiniz.
| Hipotezler | Bağımlı Değişken | Bağımsız Değişken | Kontrol Değişkeni |
|---|---|---|---|
| I. Hipotez (V–T) | Hacim (V) | Sıcaklık (T) | Basınç (P), Madde miktarı (n) |
| II. Hipotez (P–T) | Basınç (P) | Sıcaklık (T) | Hacim (V), Madde miktarı (n) |
| III. Hipotez (V–n) | Hacim (V) | Madde miktarı (n) | Basınç (P), Sıcaklık (T) |
| IV. Hipotez (V–P) | Hacim (V) | Basınç (P) | Sıcaklık (T), Madde miktarı (n) |
Açıklama:
1️⃣ Sıcaklık artarsa gazın hacmi de artar.
2️⃣ Sıcaklık artarsa gazın basıncı artar.
3️⃣ Madde miktarı artarsa hacim artar.
4️⃣ Basınç artarsa hacim azalır.
Sayfa 130
36. Soru : Her grafik için gazların ilişkilerini gösteren matematiksel eşitlikleri yazınız.
| Durum (Sabit Kalanlar) | Değişenler | Matematiksel İlişki |
|---|---|---|
| n, P sabit → V–T | V artar, T artar | V₁ / T₁ = V₂ / T₂ (Charles Yasası) |
| n, V sabit → P–T | P artar, T artar | P₁ / T₁ = P₂ / T₂ (Gay-Lussac Yasası) |
| P, T sabit → V–n | V artar, n artar | V₁ / n₁ = V₂ / n₂ (Avogadro Yasası) |
| n, T sabit → P–V | P artar, V azalır | P₁V₁ = P₂V₂ (Boyle Yasası) |
 1526
1526
10. Sınıf Kimya Ders Kitabı Sayfa 131 Cevapları (MEB Yayınları)
Soru 37 : Aşağıdakilerden hangisi verilen dört etaptan herhangi birisinin araştırma sorusu olamaz?
Cevap: C) Gaz tanecikleri bulundukları kabın her noktasına eşit oranda kuvvet uygular mı?
Kısa Açıklama: Bu ifade gaz yasalarıyla doğrudan ilişkilendirilmez; gazların basınç özelliklerini tanımlar. Diğer şıklar ise hacim, sıcaklık ve madde miktarı arasındaki niceliksel ilişkilere yöneliktir.
Soru 38 : Gazların nicelikleri ile ilişkili tabloyu tamamlayınız.
| Gaz Niceliği | Nicelikler Arasındaki İlişki |
|---|---|
| Basınç–Hacim (madde miktarı ve sıcaklık sabit) | Ters orantı – Basınç artarsa hacim azalır. (Boyle Yasası) |
| Sıcaklık–Hacim (madde miktarı ve basınç sabit) | Doğru orantı – Sıcaklık artarsa hacim artar. (Charles Yasası) |
| Basınç–Sıcaklık (madde miktarı ve hacim sabit) | Doğru orantı – Sıcaklık artarsa basınç artar. (Gay-Lussac Yasası) |
| Hacim–Madde miktarı (basınç ve sıcaklık sabit) | Doğru orantı – Madde miktarı artarsa hacim artar. (Avogadro Yasası) |
 1626
1626
10. Sınıf Kimya Ders Kitabı Sayfa 132 Cevapları (MEB Yayınları)
Soru 39 : Verilen bilgilerden yola çıkarak aşağıdaki örüntülerden hangisine ulaşılamaz?
Cevap: E) Belli bir hacimde gazların basıncı ile sıcaklığı doğru orantılıdır.
Açıklama: Sabit hacimde sıcaklık arttığında basınç artar ancak hacim sabit değilse bu ilişki doğrudan kurulamaz.
Soru 40 - Soru: Tablodaki x değerini hesaplayabileceğiniz bir bağıntı yazınız.
Cevap: İdeal gaz denkleminden yararlanılır:
P₁V₁ / T₁ = P₂V₂ / T₂
Burada x değeri basınç (P₂) olarak bulunur.
x = (P₁ × V₁ × T₂) / (T₁ × V₂)
Soru 41 : 20 L hacmindeki bir hava durumu balonu hidrojen gazı ile doldurularak 0 °C sıcaklıkta deniz seviyesinden atmosfere bırakılıyor. Balon hacmi 200 L olduğunda hava sıcaklığı -73 °C ise bu yükseklikteki açık hava basıncı kaç atm olur?
Cevap: T₁ = 0 + 273 = 273 K
T₂ = -73 + 273 = 200 K
İdeal gaz yasası:
(P₁V₁) / T₁ = (P₂V₂) / T₂
(1 × 20) / 273 = (P₂ × 200) / 200
P₂ = 20 / 273 = 0,073 atm
Soru 42 : 27 °C sıcaklık ve 1 atm basınçta bırakılan 30 L hacimli hava durumu balonu, dış basıncın 0,1 atm olduğu noktada 250 L hacme ulaştığında patlamaktadır. Bu yükseklikteki hava kaç °C sıcaklıktadır?
Cevap: T₁ = 27 + 273 = 300 K
P₁V₁ / T₁ = P₂V₂ / T₂
(1 × 30) / 300 = (0,1 × 250) / T₂
T₂ = 250 K → t = 250 – 273 = -23 °C
 1726
1726
10. Sınıf Kimya Ders Kitabı Sayfa 133 Cevapları (MEB Yayınları)
Soru 43 : Öğrenciler yapmış oldukları deneylerle ilgili aşağıdaki çıkarımlardan hangisine ulaşamaz?
Cevap: C) Sıcaklığı artan gazın difüzyon hızı da artar.
Açıklama: Öğrencilerin deneylerinde sıcaklığın difüzyon hızına etkisi doğrudan incelenmediği için bu sonuca ulaşılamaz.
Soru 44 : Öğrencilerin yaptığı deneyleri dikkate alarak günlük hayatta benzer şekilde karşılaştığınız olayları yazınız.
- Parfüm kokusunun kısa sürede tüm odaya yayılması (difüzyon).
- Gazlı içeceğin açık bırakıldığında gazını kaybetmesi.
- Balonun zamanla sönmesi.
- Yemek kokusunun mutfaktan diğer odalara yayılması.
- Araba lastiğindeki havanın yavaşça sızması.
Bu olayların tümü difüzyon ve efüzyon örnekleridir.
Soru 45: Karbonik asit oluşumuna ait tepkime denklemini yazarak alt mikro düzeyde ve aşamalı olarak modelleyiniz.
Cevap: Tepkime denklemi:
CO₂ (g) + H₂O (s) → H₂CO₃ (s)
Açıklama: Karbon dioksit gazı su ile tepkimeye girerek karbonik asit (H₂CO₃) oluşturur. Bu olay, okyanus asitlenmesi gibi çevresel etkilerin temelini oluşturur.
Soru 46
a) Tepkimede molekül türü ve molekül sayısı değişti mi?
Cevap: Evet, her ikisi de değişmiştir. Tepkimede farklı moleküller etkileşime girerek yeni moleküller oluşturmuştur.
b) Tepkimede atom türü ve sayısı değişti mi?
Cevap: Hayır, atom türü ve sayısı değişmez. Kimyasal tepkimelerde yalnızca atomların bağ yapısı değişir, atomlar yeniden düzenlenir.
c) Gerçekleşen değişim fiziksel mi yoksa kimyasal mı?
Cevap: Kimyasal bir değişimdir. CO₂ ve H₂O birleşerek yeni bir madde olan H₂CO₃’ü (karbonik asit) oluşturmuştur.
ç) Değişim kütlenin korunumu yasasına uygun mu?
Cevap: Evet, uygundur. Tepkime sonucunda atom sayısı ve türü korunmuştur. Sadece bağ yapıları değişmiş ve yeni moleküller oluşmuştur.
 1826
1826
10. Sınıf Kimya Ders Kitabı Sayfa 134 Cevapları (MEB Yayınları)
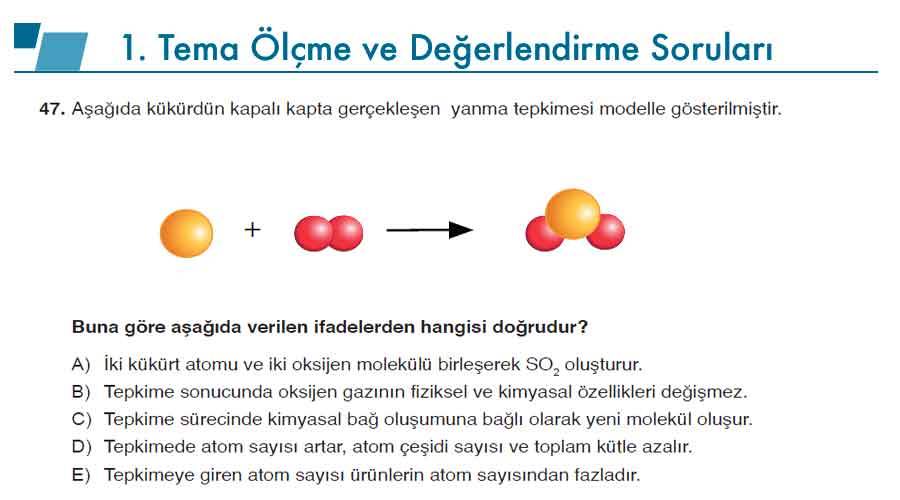
Soru 47 : Aşağıda kükürdün kapalı kapta gerçekleşen yanma tepkimesi modelle gösterilmiştir.
Buna göre aşağıda verilen ifadelerden hangisi doğrudur?
Cevap: C) Tepkime sürecinde kimyasal bağ oluşumuna bağlı olarak yeni molekül oluşur.
Açıklama: Bu tepkimede kükürt (S) ve oksijen (O₂) atomları arasında kimyasal bağ oluşumu gerçekleşmiştir. Yeni bağlar kurulduğu için SO₂ bileşiği oluşur ve bu olay kimyasal bir değişimdir.
Soru 48 : Aşağıdaki tepkimeleri en küçük sayılarla denkleştirdikten sonra alt mikro seviyede modelleyiniz.
1. Tepkime
Kimyasal tepkime: C₂H₅OH(g) + O₂(g) → CO₂(g) + H₂O(g)
Denkleştirilmiş tepkime denklemi: C₂H₅OH + 3O₂ → 2CO₂ + 3H₂O
Alt mikro seviyede gösterim: Bir etanol (C₂H₅OH) molekülü, üç oksijen (O₂) molekülüyle tepkimeye girer; iki karbondioksit (CO₂) ve üç su (H₂O) molekülü oluşur.
Bu tepkime bir yanma tepkimesi olup kimyasal enerji → ısı enerjisine dönüşür.
2. Tepkime
Kimyasal tepkime: C₂H₂(g) + O₂(g) → CO₂(g) + H₂O(g)
Denkleştirilmiş tepkime denklemi: 2C₂H₂ + 5O₂ → 4CO₂ + 2H₂O
Alt mikro seviyede gösterim: İki asetilen (C₂H₂) molekülü, beş oksijen (O₂) molekülüyle tepkimeye girerek dört karbondioksit (CO₂) ve iki su (H₂O) molekülü oluşturur.
Bu tepkime de yanma tepkimesi olup ısı ve ışık açığa çıkar.
 1926
1926
10. Sınıf Kimya Ders Kitabı Sayfa 135 Cevapları (MEB Yayınları)
Soru 49: Verilen tepkimelerin gözlemlenebilir göstergelerini yazınız.
Cevap: Birinci tepkimede gaz çıkışı (H₂ oluşumu), pH değerinde artış, katı metalin kütlesinde azalma ve bulanıklık gözlenir.
İkinci tepkimede pH değişimi ve nötrleşme tepkimesi sonucu ısı açığa çıkışı görülür.
Üçüncü tepkimede ise katı çökelti (CaCO₃) ve karbon dioksit gazı çıkışı oluşur, bu da çözeltinin bulanıklaşmasına neden olur.
Soru 50: Metinde numaralandırılmış tepkimelerin türleri hangi seçenekte doğru verilmiştir?
Cevap: B) İndirgenme-yükseltgenme tepkimesi – Asit-baz tepkimesi – Çökelme tepkimesi
- 1. Tepkime: Kalsiyum suyla tepkimeye girerek hidrojen gazı oluşturur. Bu indirgenme-yükseltgenme tepkimesidir.
- 2. Tepkime: Kalsiyum hidroksit ile asit tepkimeye girer, nötralleşme (asit-baz) tepkimesi gerçekleşir.
- 3. Tepkime: Bikarbonat iyonları ile kalsiyum iyonları çökelti oluşturur, bu da çökelme tepkimesidir.
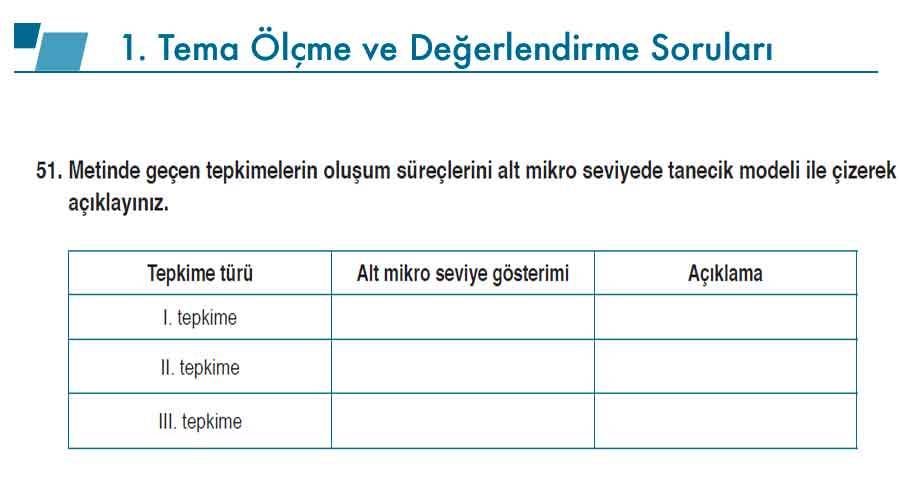
Soru 51: Tepkimelerde açığa çıkan maddeleri ve oluşum türlerini açıklayınız.
- Birinci tepkimede hidrojen gazı (H₂) açığa çıkar; bu olay indirgenme-yükseltgenme tepkimesidir.
- İkinci tepkimede su (H₂O) ve kalsiyum klorür (CaCl₂) oluşur; bu bir asit-baz tepkimesidir.
- Üçüncü tepkimede kalsiyum karbonat (CaCO₃) ve karbon dioksit (CO₂) meydana gelir; bu çökelme tepkimesidir.
 2026
2026
10. Sınıf Kimya Ders Kitabı Sayfa 136 Cevapları (Meb Yayınları)
Soru 51 - Metindeki tepkimelerin oluşum süreçlerini alt mikro düzeyde açıklayınız.
Ca + 2H₂O → Ca(OH)₂ + H₂
Kalsiyum atomu suyla yavaş tepkimeye girer. Su moleküllerindeki bağlar kırılır, hidroksit iyonları (OH⁻) ve hidrojen gazı (H₂) oluşur. Ca²⁺ iyonları OH⁻ iyonlarıyla birleşerek Ca(OH)₂ oluşturur.
Ca(OH)₂ + 2HCl → CaCl₂ + 2H₂O
Çözeltide Ca²⁺, OH⁻, H⁺, Cl⁻ iyonları bulunur. H⁺ + OH⁻ → H₂O oluşur, Ca²⁺ ve Cl⁻ iyonları birleşerek CaCl₂ oluşturur. Bu bir nötralleşme tepkimesidir.
Ca²⁺ + 2HCO₃⁻ → CaCO₃ + CO₂ + H₂O
Ca²⁺ iyonları HCO₃⁻ iyonlarıyla etkileşir. Bir kısmı CO₃²⁻’ye dönüşür ve CaCO₃ olarak çöker. CO₂ gazı açığa çıkar. Bu bir çökelme tepkimesidir.
Soru 52 - Aşağıdaki çıkarımlardan hangisi yapılamaz?
A) 0,5 mol CH₄ 8 g’dır.
B) 6,02×10²⁴ tane CH₄ molekülü 40 g H içerir.
C) 4 g C içeren bileşik 8 g’dır.
D) 0,2 mol bileşikte 1 mol atom bulunur.
E) 32 g bileşik 8 mol H atomu içerir.
Cevap: C
Açıklama: CH₄’ün mol kütlesi 16 g/mol’dür. 12 g C → 16 g CH₄ ise 4 g C → 5,33 g CH₄ olur, 8 g olamaz.
Soru 53 - 0,2 mol CH₄ için aşağıdaki tabloyu tamamlayınız.
| İstenen Değer | Sonuç |
|---|---|
| Kaç gramdır? | 3,2 g |
| Kaç gram H içerir? | 0,8 g H |
| Kaç tane C atomu içerir? | 1,204×10²³ atom C |
| Kaç mol atom içerir? | 1 mol atom |
| Kaç tane molekül içerir? | 1,204×10²³ molekül CH₄ |
 2126
2126
Sayfa 137–138 | Kimyasal Tepkimeler (54–56. Sorular)
Soru 54: Metinde geçen tepkimeleri göz önüne alarak aşağıdaki soruları cevaplayınız.
a) Bir tepkimenin denkleştirildiğini nasıl anlarsınız?
Cevap: Bir kimyasal tepkimenin denkleştirildiği, girenler ve ürünler tarafındaki atom türü ve atom sayılarının birbirine eşit olmasıyla anlaşılır. Eğer her iki tarafta da aynı türden atomlar ve aynı sayıda atom bulunuyorsa tepkime doğru şekilde denkleştirilmiştir.
b) Karbon dioksit bileşiğindeki 2, bir katsayı mı yoksa bir alt simge midir?
Cevap: CO₂ bileşiğindeki 2 sayısı bir alt simgedir. Bu sayı, bileşikte oksijen atomunun kaç tane bulunduğunu gösterir. Katsayı değildir.
c) Bir katsayıyı değiştirmek ile alt simgeyi değiştirmek arasındaki fark nedir?
Cevap: Katsayıyı değiştirmek, bileşikte bulunan tüm atomların sayısını birlikte değiştirir. Ancak alt simge değiştirilirse maddenin kimliği değişmiş olur. Bu nedenle kimyasal denklemler denkleştirilirken alt simgeler asla değiştirilmez.
ç) Kimyasal denklemler denkleştirilirken hangi kurallara dikkat edilmelidir?
- Girenler ve ürünlerdeki atom türleri aynı olmalıdır.
- Her bir atomun sayısı her iki tarafta da eşitlenmelidir.
- Alt simgeler değiştirilmemelidir.
- Katsayılar tam sayı olmalıdır.
- Genellikle en karmaşık bileşiğin katsayısı 1 alınarak denkleştirme yapılır.
Soru 55: Aşağıdaki tepkimelerdeki her bir atomun sayısını tabloya yazarak denkleştiriniz.
1. Tepkime: LiOH + CO₂ → Li₂CO₃ + H₂O
Denkleştirilmiş Tepkime: 2LiOH + CO₂ → Li₂CO₃ + H₂O
2. Tepkime: CaCO₃ + C₂H₅CO₂H → Ca(C₃H₅O₂)₂ + CO₂ + H₂O
Denkleştirilmiş Tepkime: CaCO₃ + 2C₂H₅CO₂H → Ca(C₃H₅O₂)₂ + CO₂ + H₂O
Soru 56: Aşağıda kükürt, oksijen, hidrojen, azot ve karbon elementleri temsilî şekille verilmiştir. Verilen elementlerin temsilî şekillerine dayalı olarak kimyasal tepkimeleri uygun tam sayılarla denkleştiriniz. Denkleştirdiğiniz tepkimelerin denklemlerini yazınız.
I. Tepkime: N₂ + 3H₂ → 2NH₃
II. Tepkime: 2SO₂ + O₂ → 2SO₃
III. Tepkime: CH₄ + 2O₂ → CO₂ + 2H₂O
IV. Tepkime: 2H₂O → O₂ + 2H₂
 2226
2226
Sayfa 139 – Soru ve Cevaplar
57–61. Sorular | Amonyum Dikromat Tepkimesi
Soru 57 - Denklemde tepken ve ürünlerin katsayıları ile mol sayıları arasındaki ilişkiyle ilgili olarak aşağıdakilerden hangisi söylenemez?
Verilen tepkime: (NH₄)₂Cr₂O₇ (k) → Cr₂O₃ (k) + N₂ (g) + 4H₂O (g)
A) Kullanılan amonyum dikromat miktarı bilinirse elde edilen su miktarı hesaplanabilir.
B) Tepkime sonucunda oluşan Cr₂O₃ ile N₂ gazı aynı mol sayısında oluşur.
C) Oluşan N₂ gazının miktarı bilinirse amonyum dikromatın mol sayısı hesaplanabilir.
D) Oluşan suyun kütlesi ile Cr₂O₃ bileşiğinin kütlesi birbirine eşittir.
E) Harcanan amonyum dikromatla oluşan azot gazının mol sayıları aynıdır.
Cevap: D
Açıklama: Tepkimede mol oranları katsayılara göre belirlenir; ancak kütleler, maddelerin mol kütleleri farklı olduğu için eşit olmak zorunda değildir. Bu nedenle yanlış ifade D seçeneğidir.
Soru 58 - Tepkenden 0,5 mol alındığında ürünlerin kaçar mol oluşacağına dair bir zihin haritası oluşturunuz.
Cevap: Denkleme göre:
1 mol (NH₄)₂Cr₂O₇ → 1 mol Cr₂O₃ + 1 mol N₂ + 4 mol H₂O
Orantı kurarsak: 0,5 mol (NH₄)₂Cr₂O₇ → 0,5 mol Cr₂O₃ + 0,5 mol N₂ + 2 mol H₂O
Soru 5 - 3,01 × 10²⁴ tane amonyum dikromattan kaç tane su molekülü oluşur?
Cevap: 1 mol = 6,02 × 10²³ tane tanecik
3,01 × 10²⁴ ÷ 6,02 × 10²³ = 5 mol (NH₄)₂Cr₂O₇
Tepkimeye göre:
- 1 mol (NH₄)₂Cr₂O₇ → 4 mol H₂O
- 5 mol (NH₄)₂Cr₂O₇ → 20 mol H₂O
20 mol × 6,02 × 10²³ = 1,204 × 10²⁵ tane H₂O molekülü
Soru 60 - %75 verimle gerçekleşen tepkimede 8,4 g N₂ gazı oluştuğuna göre başlangıçta kaç mol amonyum dikromat alınmıştır?
(N: 14 g/mol)
Cevap:
- N₂’nin mol kütlesi = 28 g/mol
- n(N₂) = 8,4 ÷ 28 = 0,3 mol
Tepkimede: 1 mol (NH₄)₂Cr₂O₇ → 1 mol N₂
%75 verim olduğuna göre:
Gerçekte oluşan 0,3 mol, teorik miktarın %75’idir.
0,3 = 0,75 × x
x = 0,4 mol (NH₄)₂Cr₂O₇
Soru 61 - Bir miktar amonyum dikromat ile başlatılan tepkime %100 verimle gerçekleşmiştir. Oluşan toplam ürün miktarı 0,6 mol olduğuna göre başlangıçta kaç gram amonyum dikromat kullanılmıştır?
Cevap: Denkleme göre:
1 mol (NH₄)₂Cr₂O₇ → toplam 6 mol ürün
(1 mol Cr₂O₃ + 1 mol N₂ + 4 mol H₂O)
Orantı:
- 6 mol ürün → 1 mol (NH₄)₂Cr₂O₇
- 0,6 mol ürün → 0,1 mol (NH₄)₂Cr₂O₇
Mol kütlesi: (NH₄)₂Cr₂O₇ = 252 g/mol
Kütle = n × M
0,1 × 252 = 25,2 g
 2326
2326
Sayfa 140 Cevapları
Gazların Özellikleri – 62, 63 ve 64. Sorular
Soru 62: Aşağıda gazların özellikleriyle ilgili günlük hayattan bazı örnekler verilmiştir:
I. Mutfak tüpleri, sıvılaştırılmış propan ve bütan gazlarının karışımıdır.
II. İçi su dolu bardağın ağzına kâğıt kapatılıp bardak ters çevrilirse su dökülmez.
III. Deodorant şişelerindeki itici gaz sıvının dışarıya püskürtülmesini sağlar.
IV. Sıcak hava ile doldurulan balonlar havada yükselir.
V. Anlık ve hızlı gerçekleşen bazı tepkimeler ile hava yastıklarının şişmesi gerçekleşir.
VI. Atmosferde azot, oksijen, karbon dioksit ve argon gibi çeşitli gazlar bulunur.
VII. Odanın bir köşesine sıkılan parfümün kokusu zamanla tüm odaya yayılır.
VIII. Araba ve bisiklet lastikleri hava ile doldurulur.
Bu örnek ifadelere göre gazların katı ve sıvılardan farklarına ilişkin aşağıdakilerden hangisi söylenemez?
A) Gazların belli bir hacmi ve şekli yoktur.
B) Katı ve sıvılar sıkıştırılamaz ancak gazlar sıkıştırılabilir.
C) Genleşme sadece gazlara ait bir özelliktir.
D) Parfüm kokusunun odaya yayılması gazların sıvılar gibi akışkan olduğunu gösterir.
E) Gazlar bulundukları kabın her bölgesine eşit basınç uygular.
Cevap: C) Genleşme sadece gazlara ait bir özelliktir.
Açıklama: Genleşme yalnızca gazlara özgü değildir; katı ve sıvılar da ısıtıldığında genleşir. Bu nedenle bu ifade yanlıştır.
Soru 63: Yukarıda verilen örneklerden yararlanarak gazların özelliklerine ilişkin verileri aşağıdaki tabloya kaydediniz.
| Örnek Numarası | Gazların Özelliği |
|---|---|
| I | Gazlar uygun koşullarda sıvılaştırılabilir ve karışım oluşturabilir. |
| II | Gazlar basınç uygular. |
| III | Gazlar basınç etkisiyle maddeleri hareket ettirebilir. |
| IV | Isınan gazların yoğunluğu azalır, yükselir. |
| V | Gazlar hızlı tepkimelerle kısa sürede hacim artışı sağlayabilir. |
| VI | Gazlar birbirleriyle her oranda homojen karışır. |
| VII | Gazlar bulundukları ortama yayılır (difüzyon). |
| VIII | Gazlar sıkıştırılabilir ve bulundukları kabı doldurur. |
Soru 64: Aşağıdaki ifadelerden yola çıkarak gazların her bir özelliğini tanecik modelleri üzerinden açıklayınız.
1. Gazlar bulundukları kabın şeklini ve hacmini alır.
Gaz tanecikleri arasında çok fazla boşluk vardır ve tanecikler serbestçe hareket eder. Bu nedenle gazlar kabın tamamını doldurur.
2. Gazlar birbiri ile her oranda homojen karışır.
Tanecikler sürekli ve rastgele hareket ettiği için gazlar kısa sürede eşit şekilde dağılır.
3. Gazlar bulundukları kabın her yerine basınç uygular.
Gaz tanecikleri her yöne hareket ederek kabın tüm yüzeylerine çarpar ve eşit basınç oluşturur.
4. Gazlar sıkıştırılabilir.
Tanecikler arasındaki boşluk fazla olduğu için dış basınçla tanecikler birbirine yaklaştırılabilir.
5. Gazlar bulundukları ortama yayılır.
Taneciklerin rastgele hareketi sayesinde gazlar boşluklara doğru ilerler ve ortama yayılır.
6. Gazlar ısıtıldığında genleşir ve yoğunlukları azalır.
Isı artışıyla taneciklerin kinetik enerjisi artar, tanecikler daha hızlı hareket eder ve aralarındaki mesafe büyür.
 2426
2426
10. Sınıf Kimya Ders Kitabı Cevapları MEB Yayınları Sayfa 141–145
Sayfa 141 Cevapları
Soru 65 - Buna göre öğrencinin araştırmalarında aşağıdaki sorulardan hangisini sorması beklenmez?
A) Topun küçülmesinin nedeni içindeki havanın azalması olabilir mi?
B) Topun daha az zıplamasının nedeni içindeki basıncın azalması olabilir mi?
C) Topun beton zeminde kalması ile küçülmesi arasında ilişki var mıdır?
D) Top dıştan bir etki olmaksızın küçülmüş olabilir mi?
E) Top sıcak bir ortama bırakılırsa eski hâline gelir mi?
Cevap: D) Top dıştan bir etki olmaksızın küçülmüş olabilir mi?
Açıklama: Topun hacim ve basıncındaki değişimler gaz yasaları, sıcaklık ve basınç ile ilgilidir. Dış etki olmadan gazın kendiliğinden küçülmesi beklenmez.
Sayfa 142 Cevapları
Soru 66 - Basınç–hacim, sıcaklık–hacim, sıcaklık–basınç ve madde miktarı–hacim ilişkilerine ait hipotezler oluşturunuz. Bağımlı, bağımsız ve kontrol değişkenlerini yazınız.
Hipotez 1 (Boyle Yasası)
- Hipotez: Sıcaklık ve mol sabitken hacim azalırsa basınç artar.
- Bağımlı değişken: Basınç (P)
- Bağımsız değişken: Hacim (V)
- Kontrol değişkenleri: Sıcaklık (T), madde miktarı (n)
Hipotez 2 (Charles Yasası)
- Hipotez: Basınç ve mol sabitken sıcaklık artarsa hacim artar.
- Bağımlı değişken: Hacim (V)
- Bağımsız değişken: Sıcaklık (T)
- Kontrol değişkenleri: Basınç (P), madde miktarı (n)
Hipotez 3 (Gay-Lussac Yasası)
- Hipotez: Hacim ve mol sabitken sıcaklık artarsa basınç artar.
- Bağımlı değişken: Basınç (P)
- Bağımsız değişken: Sıcaklık (T)
- Kontrol değişkenleri: Hacim (V), madde miktarı (n)
Hipotez 4 (Avogadro Yasası)
- Hipotez: Basınç ve sıcaklık sabitken gaz miktarı artarsa hacim artar.
- Bağımlı değişken: Hacim (V)
- Bağımsız değişken: Madde miktarı (n)
- Kontrol değişkenleri: Basınç (P), sıcaklık (T)
Sayfa 143 Cevapları
Soru 67 - Deney görsellerini uygun gaz yasalarıyla ilişkilendiriniz.
Görsel 1 – Boyle Yasası
T ve n sabitken: Basınç arttıkça hacim azalır.
Görsel 2 – Charles Yasası
P ve n sabitken: Sıcaklık arttıkça hacim artar.
Görsel 3 – Gay-Lussac Yasası
V ve n sabitken: Sıcaklık arttıkça basınç artar.
Görsel 4 – Avogadro Yasası
P ve T sabitken: Gaz miktarı arttıkça hacim artar.
Sayfa 144 Cevapları
Soru 68 - Grafiklere uygun matematiksel modelleri yazınız.
Charles Yasası (n ve P sabit): V₁ / T₁ = V₂ / T₂
Gay-Lussac Yasası (n ve V sabit): P₁ / T₁ = P₂ / T₂
Avogadro Yasası (P ve T sabit): V₁ / n₁ = V₂ / n₂
Boyle Yasası (n ve T sabit): P₁ · V₁ = P₂ · V₂
Sayfa 145 Cevapları
Soru 69 - Gaz yasalarını kinetik teoriye göre açıklayınız.
Boyle Yasası: Hacim azaldığında tanecikler daha sık çarpışır, bu da basıncı artırır.
Charles Yasası: Isıtılan gazda taneciklerin hızı artar, kap genişleyerek hacim büyür.
Gay-Lussac Yasası: Sabit hacimde ısıtılan gazda taneciklerin çarpma enerjisi artar ve basınç yükselir.
Avogadro Yasası: Tanecik sayısı arttıkça çarpışmalar artar, basıncı sabit tutmak için hacim artar.
 2526
2526
Sayfa 145 Cevapları
70–72. Sorular (Hava Yastıkları ve Gaz Yasaları)
Soru 70 - Hava yastıklarının tasarım ve üretiminin yapıldığı bir fabrikada çeşitli deneyler sonucu N₂ gazına ait grafikler oluşturulmuştur.
Grafiklerden yola çıkılarak bir hava yastığının en hızlı ve kolay şekilde şişmesi için aşağıdakilerden hangisi yapılabilir?
Cevap A) Kullanılan NaN₃ miktarı ve sıcaklık değeri artırılmalıdır.
Açıklama: Gaz yasalarına göre gazın mol sayısı (n) ve sıcaklık (T) arttıkça hacim artar. Hava yastığının hızlı şişmesi için daha fazla gaz üretilmeli ve gazın sıcaklığı artırılmalıdır. Bu da NaN₃ miktarının ve sıcaklığın artırılmasıyla sağlanır.
Sayfa 146 Cevapları
Soru 71 - Bir gazın hacminin bağlı olduğu niceliklere ilişkin bir ifade yazınız.
Cevap - Bir gazın hacmi; gazın mol sayısına (n) ve sıcaklığına (T) doğru orantılı, basıncına (P) ise ters orantılıdır.
Bu ilişki ideal gaz denklemi (PV = nRT) ile ifade edilir.
Soru 72 - Bir otomobilin hava yastığını şişirmek için 65 g NaN₃ bileşiği kullanılmıştır.
Hava yastığının 1 atm basınçlı ortamda açıldığı andaki hacmi yaklaşık 82 L olduğuna göre, tepkimenin gerçekleştiği ortamın sıcaklığı kaç °C’dir?
(N: 14 g/mol, Na: 23 g/mol)
Çözüm
1. NaN₃’ün mol kütlesi:
NaN₃ = 23 + (14 × 3) = 65 g/mol
2. Alınan NaN₃ molü:
65 g → 1 mol NaN₃
3. Tepkimeye göre:
2 NaN₃ → 3 N₂
1 mol NaN₃ → 1,5 mol N₂
4. İdeal gaz denklemi:
P·V = n·R·T
1 × 82 = 1,5 × 0,082 × T
T ≈ 666,7 K
5. Celsius’a çevirme: T(°C) = 666,7 − 273 ≈ 393,7 °C
Cevap
Tepkimenin gerçekleştiği ortamın sıcaklığı yaklaşık olarak 394 °C’dir.
 2626
2626
10. Sınıf Kimya Ders Kitabı Cevapları – Sayfa 146–147
Gazlarda Difüzyon ve Yayılma
Soru 73 - Hangi gazın dedektöre en hızlı ulaşmasını beklersiniz? Neden?
Cevap: Molekül kütlesi en küçük olan gaz dedektöre en hızlı ulaşır. Çünkü molekül kütlesi azaldıkça taneciklerin ortalama hızı artar ve difüzyon daha hızlı gerçekleşir.
Bu nedenle verilen gazlar arasında CH₄ (metan) en hızlı yayılan gazdır.
Soru 74 - Sabit sıcaklıkta gazların dedektöre ulaşma sürelerini kıyaslayınız.
Cevap: Molekül kütlesi büyük olan gaz daha yavaş yayılır.
Gazların dedektöre ulaşma süresi (yavaştan hızlıya doğru):
SO₂ > H₂S > CO > CH₄
Soru 75 - Cam tüpün bir ucundan CO₂, diğer ucundan X gazı aynı anda gönderiliyor. Gazlar 5. noktada karşılaştığına göre X gazı hangileri olabilir? Açıklayınız.
Cevap: Gazlar aynı sürede eşit mesafe aldıklarına göre molekül kütleleri eşittir.
CO₂’nin mol kütlesi: 12 + 2×16 = 44 g/mol
Seçenekler incelendiğinde:
- C₃H₈ = 44 g/mol
- N₂O = 44 g/mol
✔ X gazı: C₃H₈ ve N₂O olabilir.
Soru 76 - Bölmeli kapta H₂ ve N₂ gazları bulunmaktadır. B bölmesine hangi gaz daha önce geçer? Neden?
Cevap: H₂ gazı, mol kütlesi daha küçük olduğu için N₂ gazından daha hızlı yayılır.
Bu nedenle B bölmesine önce H₂ geçer.
Soru 77 - Aşağıdakilerden hangisi difüzyon örneği değildir?
A) Çamaşır suyu kullanımıyla Cl₂ gazının yayılması
B) Pişen yemek kokusunun mutfağa yayılması
C) Doğal gazın borudaki delikten dışarı kaçması
D) Mum ve tütsü yakıldığında dumanın odaya yayılması
E) Parfüm kokusunun oda içine dağılması
Cevap: C) Doğal gazın borudaki delikten dışarı kaçması
Çünkü bu olay difüzyon değil, basınç farkına bağlı akış (efüzyon) örneğidir.


Türkçe karakter kullanılmayan ve büyük harflerle yazılmış yorumlar onaylanmamaktadır.