9. Sınıf Kimya Ders Kitabı Sayfa 138-139 Cevapları Meb Yayınları

9. Sınıf Kimya Ders Kitabı Sayfa 138-139 Cevapları (MEB Yayınları)
Soru: Bazı elementler ve kovalent bağlı bileşikler moleküler yapıdadır. Moleküllerin oluşumunda polar ya da apolar kovalent bağlar etkilidir. Molekülü oluşturan atomları bir arada tutan bağların polarlığı molekülün polarlığını nasıl etkiler? Molekül polarlığını etkileyen faktörler nelerdir?
Cevap (Kısa ve Net): Bir moleküldeki bağlar polar ise elektronlar eşit dağılmadığı için molekülün bir ucu kısmen negatif, diğer ucu kısmen pozitif olur. Bu da molekülü polar yapar. Bağlar apolar ise molekül genelde apolar olur. Molekülün polarlığını belirleyen iki temel faktör vardır: bağların polarlığı ve molekülün geometrik yapısı.
Diğer Tablolu Soruların Cevabı:
➡️ Bu bölümde tablo doldurma ve moleküllerin polar–apolar yorumları Sayfa 139’da tamamlanmaktadır.
Molekül Polarlığı ve Apolarlığı Soruları ve Cevapları:
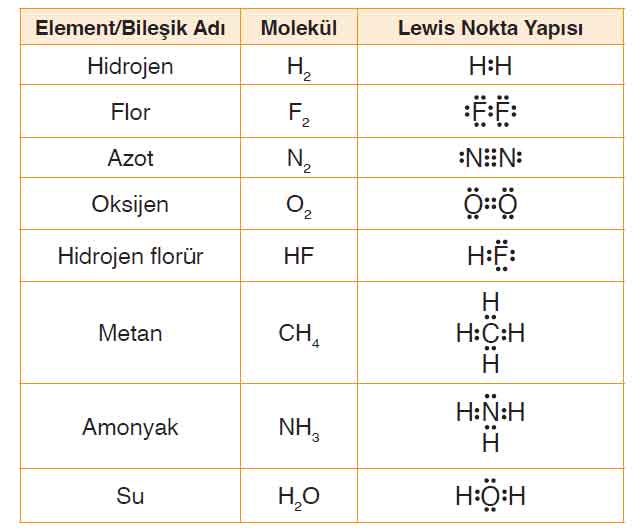
1. Tablodaki boşluklarda moleküllerin Lewis nokta yapısını gösteriniz.
Lewis yapıları tabloda verilmiştir (H₂, F₂, N₂, O₂, HF, CH₄, NH₃, H₂O).
Cevap: Lewis nokta yapıları:
- Hidrojen (H₂): H:H
- Flor (F₂): F:F
- Azot (N₂): N≡N
- Oksijen (O₂): O=O
- Hidrojen Florür (HF): H:F
- Metan (CH₄): H-C-H (çevresinde 4 H atomu)
- Amonyak (NH₃): H-N-H (çevresinde yalnız çift elektron)
- Su (H₂O): H-O-H (çevresinde 2 yalnız çift elektron)
Soru 2 Moleküllerin uzay-dolgu modellerini etkileyen faktörler neler olabilir?
Cevap: Moleküllerin uzay-dolgu modellerini etkileyen faktörler:
- Atomların elektronegatiflik değerleri
- Valans elektron sayıları
- Merkez atomdaki ortaklanmamış elektron çiftleri
- Molekül geometrisi
- Bağların polar veya apolar oluşu
Soru 3 Verilen moleküllerden farklı gruplar oluşturmak için ölçütler belirleyiniz.
Elektron yük dağılımı dengesi:
- Dengeli olanlar: H₂, F₂, N₂, O₂, CH₄
- Dengeli olmayanlar: HF, NH₃, H₂O
Dipol moment:
- Dipol momenti sıfır olanlar: H₂, F₂, N₂, O₂, CH₄
- Dipol momenti sıfırdan farklı olanlar: HF, NH₃, H₂O
Soru 4 Belirlediğiniz ölçütlere göre molekülleri ayrıştırınız.
- Apolar moleküller: H₂, F₂, N₂, O₂, CH₄
- Polar moleküller: HF, NH₃, H₂O
Soru 5 Dipol moment, molekülün kutupsallığının ölçüsüdür. Buna göre tablodaki molekülleri dipol momentine göre gruplayınız.
- Dipol momenti sıfır olanlar: H₂, F₂, N₂, O₂, CH₄
- Dipol momenti sıfırdan farklı olanlar: HF, NH₃, H₂O
Soru 6 Dipol momenti sıfır olan moleküller apolar, sıfırdan farklı olan moleküller ise polar olarak adlandırılır. Buna göre tablodaki polar ve apolar molekülleri belirleyiniz.
- Apolar moleküller: H₂, F₂, N₂, O₂, CH₄
- Polar moleküller: HF, NH₃, H₂O
Genel Çıkarımlar:
- Molekülün polar olup olmaması, elektronegatiflik farklarına ve geometrik dizilimine bağlıdır.
- Polar moleküller, yük dağılımının dengesiz olduğu moleküllerdir.
- Apolar moleküllerde elektron yoğunluğu eşit dağılır, dipol moment sıfırdır.
Not: Görsel bilgilerin açıklamaları yukarıdaki Lewis ve dipol gruplandırmalarını desteklemektedir.







Türkçe karakter kullanılmayan ve büyük harflerle yazılmış yorumlar onaylanmamaktadır.