9. Sınıf Kimya Ders Kitabı Sayfa 84 Cevapları Meb Yayınları

9. Sınıf Kimya Ders Kitabı Sayfa 84 Cevapları (MEB Yayınları)
Etkinlik 1.17 – İyonlaşma Enerjisi II
Soru: Çizdiğiniz grafikte hangi atomların iyonlaşma enerjisinden sonra düşüş gözlenmektedir? Bu düşüşün nedenini açıklayınız.
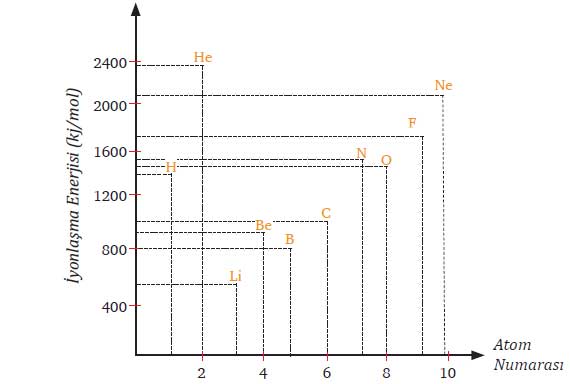
Cevap: Grafikte Be – B ve O – N element çiftlerinde iyonlaşma enerjisinde düşüş gözlenmektedir.
B’nin (Bor) iyonlaşma enerjisi, Be’nin (Berilyum) çekirdek yükü daha küçük olmasına rağmen daha düşüktür. Çünkü Be’nin elektron dizilimi kararlı (2s²) yapıdadır, B’nin ise 2p¹ elektronuna sahiptir ve bu elektronu koparmak daha kolaydır.
Oksijen (O) elementinin iyonlaşma enerjisi, azotunkinden (N) daha düşüktür. Bunun nedeni O atomunda 2p⁴ orbitalinde elektron eşleşmesi olmasıdır. Eşleşen elektronlar arasındaki itme kuvveti, bir elektronun koparılmasını kolaylaştırır.
Bu nedenle azotun iyonlaşma enerjisi oksijenden daha yüksektir.
Ek Açıklama: Periyodik tabloda soldan sağa gidildikçe genel olarak iyonlaşma enerjisi artar.
Ancak bazı özel durumlar (örneğin 2A–3A ve 5A–6A grupları arasında) bu artışta düzensizlikler görülmesine yol açar.
Bunun nedeni elektron dizilimlerinin kararlılık farkıdır.
İyonlaşma Enerjisindeki Genel Sıra:
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A








Türkçe karakter kullanılmayan ve büyük harflerle yazılmış yorumlar onaylanmamaktadır.