9. Sınıf Kimya Ders Kitabı Sayfa 86-87-88-89 Cevapları Meb Yayınları

9. Sınıf Kimya Ders Kitabı Sayfa 86-87 Cevapları (MEB Yayınları)
Etkinlik 1.19 – Elektronegatiflik
1. Soru: Periyodik tablonun aynı periyodundaki elektronegatifliğin değişimine neden olan etmenler nelerdir? Bu değişimin nedenini elektrostatik çekim kuvveti temelinde açıklayınız.
Cevap: Aynı periyotta soldan sağa gidildikçe proton sayısı artar. Bu artış çekirdeğin elektronlara uyguladığı çekim kuvvetini güçlendirir.
Bu nedenle elektronegatiflik değeri artar, çünkü atomlar elektronları kendine çekme eğiliminde olur.
2. Soru: Periyodik tablonun aynı grubundaki elektronegatifliğin değişimine neden olan etmenler nelerdir? Bu değişimin nedenini elektrostatik çekim kuvveti temelinde açıklayınız.
Cevap: Aynı grupta yukarıdan aşağıya inildikçe atom yarıçapı artar ve valans elektronları çekirdekten uzaklaşır.
Bu durumda çekirdeğin pozitif yükü elektronları daha az çeker.
Bu nedenle elektronegatiflik azalır.
3. Soru: Elektronegatiflik, bir periyotta soldan sağa ve bir grupta yukarıdan aşağıya doğru nasıl değişir? Bu durumu bir örnekle açıklayınız.
Cevap: Elektronegatiflik periyotta soldan sağa artar, grupta yukarıdan aşağıya azalır.
Örneğin; 2. periyotta Li (0,98) < Be (1,57) < B (2,04) < C (2,55) < N (3,04) < O (3,44) < F (4,00) şeklinde artış görülür.
4. Soru: Tablodaki en yüksek ve en düşük elektronegatifliğe sahip elementler hangileridir?
- En yüksek elektronegatiflik: Flor (F) → 4,00
- En düşük elektronegatiflik: Potasyum (K) → 0,82
5. Soru: Metallerin, ametallerin ve soy gazların elektronegatiflikleri karşılaştırıldığında hangi genellemelere ulaşılabilir?
- Ametallerin elektronegatifliği yüksektir, çünkü elektron çekme eğilimleri fazladır.
- Metallerin elektronegatifliği düşüktür, çünkü elektron verme eğilimindedirler.
- Soy gazlar kimyasal bağ yapmadıkları için elektronegatiflikleri tanımlanmaz.
9. Sınıf Kimya Ders Kitabı Sayfa 87–89 Cevapları (MEB Yayınları)
Kontrol Noktası 1.8
1. Soru: Mg ve S atomları tepkimeye girerek MgS bileşiğini oluşturmaktadır. Bu tepkime gerçekleşirken atomların yarıçapları şekildeki gibi değişmektedir.
Buna göre şekildeki atom ve iyonları belirleyiniz. Seçiminizin nedenini açıklayınız.
Cevap: Büyük mavi küre Mg atomu, küçük mavi küre Mg²⁺ iyonudur.
Küçük yeşil küre S atomu, büyük yeşil küre ise S²⁻ iyonudur.
Açıklama: Magnezyum elektron verdiğinde (+2 yüklü katyon) yarıçapı küçülür; sülfür elektron aldığında (−2 yüklü anyon) yarıçapı büyür. Bu nedenle Mg atomu küçülürken S atomu büyümüştür.
Sayfa 88 Cevapları
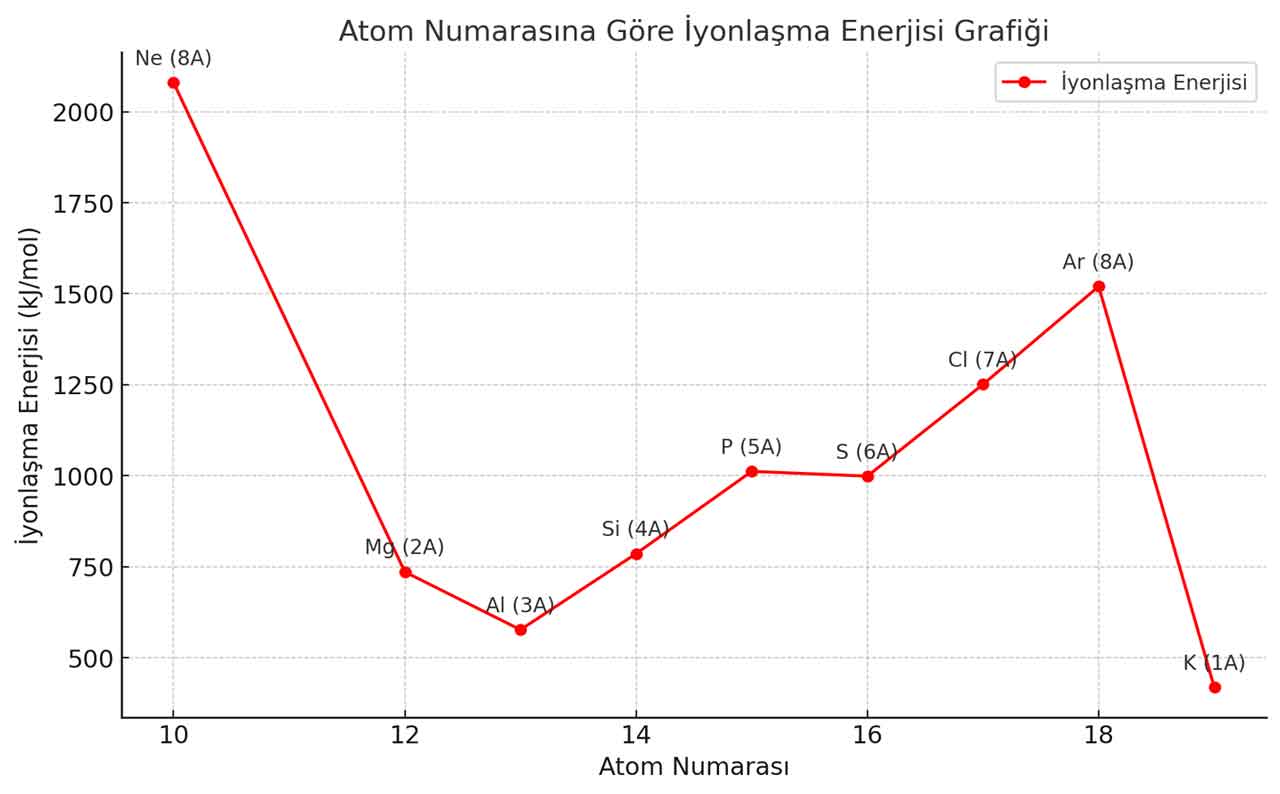
2. Soru: Verilen elementlerin iyonlaşma enerjisi grafiğini çizerek grafikteki düşüşlerin nedenini açıklayınız.
Cevap: İyonlaşma enerjisi genel olarak soldan sağa doğru artar; fakat 3A ve 6A gruplarında hafif düşüşler görülür.
Bu düşüşün nedeni, yarı dolu orbital kararlılığı ve orbital elektron itmeleridir.
Örneğin, Be → B geçişinde 2p orbitallerinin dolmaya başlaması nedeniyle iyonlaşma enerjisinde düşüş olur.
Aynı şekilde N → O geçişinde elektron itmeleri nedeniyle düşüş gözlenir.
3. • H-F bağındaki elektronlar F,
• H-Cl bağındaki elektronlar Cl,
• F-Cl bağındaki elektronlar F atomu tarafından daha çok çekilmektedir.
H, F ve Cl atomlarının elektronegatifliklerini karşılaştırarak elektronegatifliğin tanımını yazınız.
Elektronegatiflik Tanımı:
Kimyasal bağ yapan bir atomun, bağ elektronlarını kendine çekme gücüne elektronegatiflik denir.
H, F ve Cl Atomlarının Elektronegatiflik Karşılaştırması:
- F > Cl > H
- Flor, periyodik tabloda en yüksek elektronegatiflik değerine sahip elementtir ve bağ elektronlarını diğer elementlerden daha güçlü çeker.
4. • X atomunun iyonlaşma enerjisi en büyüktür.
• Y atomunun atom yarıçapı en büyüktür.
• K atomunun valans elektron sayısı Y atomuna eşittir.
• Z atomunun valans elektron ve enerji seviyesi sayısı K ve X atomlarından farklıdır.
Verilen özelliklerden hareketle X, Y, Z ve K elementlerini aşağıdaki periyodik tablo kesitine yerleştiriniz.
Gerekçelerinizi ilgili alana yazınız.
- X: İyonlaşma enerjisi en büyük.
- Y: Atom yarıçapı en büyük.
- K: Y ile aynı valans elektron sayısına sahip.
- Z: Enerji seviyesi sayısı K ve X'ten farklı.
Periyodik Tabloda Yerleştirme:
- X: Sağ üst köşe (iyonlaşma enerjisi büyük).
- Y: Sol alt köşe (atom yarıçapı büyük).
- K ve Y: Aynı grupta.
- Z: Alt ve orta bölümde (farklı enerji seviyesi).
Sayfa 89 Cevapları
5. Aşağıda X, Y ve Z elementleri ile ilgili bazı bilgiler verilmiştir. Bu bilgilerden yararlanarak soruları cevaplayınız.
a) X, Y ve Z elementlerinin elektronegatifliklerini karşılaştırınız.
Cevap: Elektronegatiflik, periyodik tabloda soldan sağa doğru artar, bu yüzden sıralama: Z > Y > X.
b) X, Y ve Z elementlerinin valans elektron sayılarını yazınız.
- X = 1 valans elektron
- Y = 2 valans elektron
- Z = 3 valans elektron
c) X, Y ve Z elementlerinin atom yarıçaplarını karşılaştırınız.
Cevap: Atom yarıçapı, sağdan sola ve yukarıdan aşağıya arttığı için sıralama: X > Y > Z.
ç) X⁺, Y²⁺ ve Z³⁺ iyonlarının elektron dağılımındaki son orbitali ve bu orbitaldeki elektron sayısını yazınız.
Cevap: Son orbital: 2p⁶. Bu orbitalin elektron sayısı: 6.
d) X, Y ve Z elementlerinin grup numaralarına karşılık gelen iyonlaşma enerjilerinin değişimini gösteren bir grafik çiziniz.
Açıklama: Periyodik tabloda soldan sağa gidildikçe iyonlaşma enerjisi artar, ancak grup içindeki elementlerde yukarıdan aşağıya indikçe iyonlaşma enerjisi azalır. Grafik, soldan sağa doğru yükselen bir eğri şeklinde olacaktır.
e) X, Y ve Z elementlerinin birbirine göre konumlarını gösteren bir periyodik tablo kesiti çiziniz.
3. periyotta:
- 1A → X
- 2A → Y
- 3A → Z
Diziliş: X – Y – … – Z




Türkçe karakter kullanılmayan ve büyük harflerle yazılmış yorumlar onaylanmamaktadır.