9. Sınıf Kimya Ders Kitabı Sayfa 90-105 Cevapları Meb Yayınları
1. Tema Ölçme ve Değerlendirme Soruları
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 90
1-3. soruları aşağıdaki metin ve tablolara göre cevaplayınız.
Sayfa 90 - Soru 1: Bu bilimsel çalışma hangi davranışlar için yapılmış olabilir?
Doğru seçenek: B) I ve II
Açıklama: Bu araştırma, özellikle plastiklerdeki ağır metal geçişini incelerken asidik ortamların etkisini ele almıştır. Kahve içmek (I) ve turşu saklamak (II) bu kapsama girer, çünkü her iki durumda da sıcaklık veya asidik yapının metal geçişini artırma potansiyeli vardır. Ancak plastik şişelerde süt tüketmek (III) ve sıvı sabun ambalajı kullanmak (IV) gibi durumlar bu çalışmanın odağında değildir, zira çalışma, daha çok asidik koşulların metal geçişine etkisiyle ilgilidir.
Sayfa 90 - Soru 2: Bu çalışmayla ilgili hangisi doğrudur?
Cevap: Doğru seçenek: D) Köpük bardaklardaki kurşun oranı yemek saklama kaplarındaki kurşun oranından azdır.
Köpük bardaklarda kahve gibi sıcak içeceklerin tüketilmesiyle kurşun ve kadmiyum geçişi olur, ancak yapılan araştırmada kurşun oranı, yemek saklama kapları gibi uzun süreli temas ortamlarındaki oranlardan düşüktür.
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 91
Sayfa 91 - Soru 3: Bu çalışmaya göre hangi genellemeye ulaşılamaz?
Cevap: Doğru seçenek: C) Plastik maddenin içerdiği ağır metal ile gıdaya geçen ağır metal doğru orantılıdır.
Bu genellemeye ulaşılamaz, çünkü plastiklerdeki ağır metal oranı her zaman gıdaya geçen miktarla doğrudan orantılı olmayabilir. Farklı plastik türleri, ortam koşulları ve temas süresi metal geçişini etkileyebilir.
4-6. soruları aşağıdaki metin ve tabloya göre cevaplayınız.
Sayfa 91 - Soru 4. Anket sorularını laboratuvar güvenlik kuralları açısından kaç farklı kategoride gruplayabilirsiniz? Nedenini açıklayınız.
Cevap: Dört farklı kategoride sınıflandırılabilir. 1 ve 8. soru genel laboratuvar kuralları; 2, 3, 5 ve 6. soru kimyasal madde ile çalışılırken uyulması gereken kurallar; 4 ve 9. sorular ölçüm aletleri ile çalışılırken uyulması gereken kurallar; 7 ve 10. sorular cam malzeme ile çalışılırken uyulması gereken kurallar.
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 92
Sayfa 92 - Soru 5- Aşağıda anket sonuçları ile ilgili bazı cümleler verilmiştir.
a) Her bir cümlenin hangi anket sorusu veya sorularıyla ilişkili olduğunu açıklayınız.
- I-6: Tehlikeli maddelerin uygun saklanması.
- II-8: Gaz çıkışlı deneylerde etkilenme riskinin düşük olması.
- III-5: Toksik maddelerle temas riski.
- IV-9: Hacim ölçümünün doğru yapılması.
- V-1, 2, 3: Ekipman kullanımı ve kimyasallarla dikkatli çalışma.
- VI-10: Cam malzemelerin doğru sterilizasyonu.
- VII-7: Cam malzemelerle ilgili kazaların önlenmesi.
b) Yukarıdaki cümlelerin anket verileri ile uyumlu olup olmadığını açıklayınız.
- II: Uyumsuz. Gaz çıkışlı deneylerde sadece %25 oranında çeker ocak kullanımı var.
- IV: Uyumsuz. Beherler hacim ölçümü için uygun değildir, ancak %90 oranında evet denmiş.
- VII: Uyumsuz. %35 oranında tıpa takarken kayganlaştırıcı kullanılmış, bu oran düşük kalmaktadır.
Sayfa 92 - Soru 6- Bu çalışmadan öğrencilerle ilgili aşağıda verilen çıkarımlardan hangisine ulaşılabilir?
Cevap: D- Gaz çıkışı olan deneylerde öğrenciler, risk oluşturacak davranışlardan kaçınmışlardır.
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 93
7-9. soruları aşağıdaki grafiklere göre cevaplayınız.
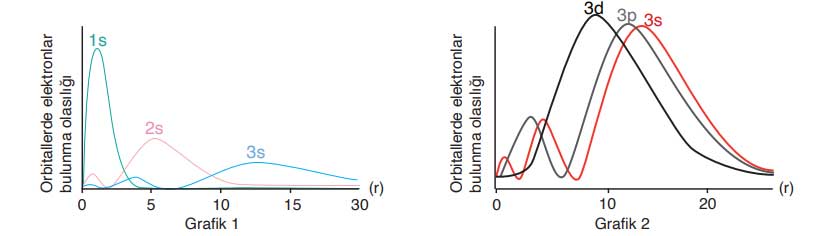
Soru 7: Aşağıdaki önermelerden hangisi Grafik 1’den elde edilebiliyorken Grafik 2’den elde edilemez?
A) 2p atom orbitallerinin enerjisi 2s atom orbitallerinin enerjisinden büyüktür.
B) Bir atomda enerji seviyesi arttıkça atom orbitallerinin enerjisi artar.
C) Aynı enerji seviyesinde 3p orbitallerinin enerjisi 3s orbitallerinin enerjisinden büyüktür.
D) Aynı periyottaki atomlarda elektron sayısı arttıkça valans elektronlarının bulunduğu orbitallerin enerjisi düşer.
E) Atom orbitallerinin enerjileri birbirinden farklıdır.
Cevap: B
Grafik 1, atom numarası ve orbital enerji seviyeleri arasındaki ilişkiyi gösterir. Ancak enerji seviyesiyle orbital enerji artışı Grafik 2’den elde edilemez; bu bilgi Grafik 1’in bir sonucudur.
Soru 8: Aşağıdaki cümlelerde atom orbitallerinin enerjileri ile ilgili önermeler verilmiştir.
Grafiklerden önermeleri destekleyecek veri örnekleri yazınız:
-
Aynı enerji seviyesindeki d orbitallerinin enerjisi p ve s orbitallerinden fazladır.
Cevap: Grafik 1’de atom numarası 21 olan elementte 3d orbitalinin enerjisinin 3p ve 3s’den büyük olduğu görülmektedir. -
4s orbitalinin enerjisi 3d orbitalinin enerjisinden düşüktür.
Cevap: Bu önerme Grafik 1’den çıkarılabilir, çünkü 4s orbitalinin enerjisi 3d’den düşük olarak gösterilir. -
Bir atomda 3p orbitallerinin enerjisi 2p orbitallerinden büyüktür.
Cevap: Grafik 1’de 15 numaralı elementte 3p orbitalinin enerjisinin 2p’den büyük olduğu anlaşılabilir.
Veri ile destekleyemediğiniz önermeler için grafiğe eklenmesi gereken bilgiler:
Desteklenemeyen önermeleri doğrulamak için grafiklere ek olarak deneysel verilere veya ölçüm sonuçlarına ihtiyaç duyulur.
Soru 9: Grafiklere göre aşağıdakilerden hangisi doğrudur?
- Aynı periyotta atom numarası arttıkça atom orbitallerinin enerjileri düşmektedir.
- Aynı periyottaki atomlarda elektron sayısı arttıkça valans elektronlarının bulunduğu orbitallerin enerjisi farkı artar.
- Aynı gruptaki atomlarda elektron sayısı arttıkça valans elektronlarının bulunduğu orbitallerin enerjisi farkı azalır.
A) Yalnız I B) Yalnız II C) Yalnız III D) I ve III E) I, II ve III
Cevap: E
Her üç önerme de grafiklerde gösterilen verilere dayanarak doğrulanabilir. Aynı periyotta atom numarası arttıkça enerji seviyelerinin düştüğü, valans elektronlarının enerjisindeki farkların arttığı, ve gruplar arasında bu farkın azaldığı gözlemlenebilir.
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 94-95
10-14. soruları aşağıdaki metin, görsel ve grafiklere göre cevaplayınız.
Soru 10: Deney düzeneklerinde verilen temizlik kimyasal ürünlerinin yaklaşık pH değerlerini belirleyiniz ve her birini asidik, bazik veya nötr olarak sınıflandırınız.
Cevap: Tuz ruhu asidik, yüzey temizleyici nötr, çamaşır suyu ise bazik özelliktedir.
- Tuz ruhu: pH ≈ 1 (Asidik)
- Çamaşır suyu: pH ≈ 13 (Bazik)
- Yüzey temizleyici: pH ≈ 7 (Nötr)
Soru 11: Kullanılan temizlik kimyasallarının doğal taşın yüzey rengine etkisini en yüksekten en düşüğe doğru sıralayınız.
Cevap: Tuz ruhu > Çamaşır suyu > Yüzey temizleyici
Açıklama: Tuz ruhu, asidik özellik göstererek doğal taşla tepkimeye girip renk değişimi ve aşınmaya neden olur. Çamaşır suyu, bazik olması nedeniyle benzer bir etki yapar ama yüzey temizleyici nötr olduğundan en az etkiyi gösterir.
Soru 12: Aşağıdaki deney düzeneklerinde hangi temizlik kimyasalı kullanılmış olabilir? Açıklayınız.
a) Tuz ruhu (HCl): Asidik yapısı ile doğal taş üzerinde aşınmaya sebep olmuştur.
b) Çamaşır suyu (NaClO): Bazik yapısıyla renk değişikliği gözlenir.
c) Yüzey temizleyici: Nötr özellikte olup en az etkiyi göstermiştir.
Soru 13: Kullanılan tuz ruhu (HCl) doğal taşın (CaCO₃) kütlesinde yüzde kaç aşınmaya neden olmuştur? Tepkimeyi yorumlayınız.
Cevap: Tuz ruhu doğal taşla (CaCO₃) tepkimeye girerek aşınmaya neden olur. Kimyasal denklemi:
CaCO₃ (katı) + 2 HCl (sulu) → CaCl₂ (sulu) + CO₂ (gaz) + H₂O (sıvı)
Bu tepkime sonucunda %2 aşınma meydana gelmiştir. Asidik özellikteki HCl, CaCO₃ ile reaksiyona girerek karbon dioksit (CO₂) gazı açığa çıkar ve bu da yüzeyde kütle kaybına sebep olur.
Soru 14: Bu araştırmadan çıkardığınız sonuçlara göre doğal taş yüzeylerin temizliği için hangi özellikteki temizlik ürünlerini seçersiniz? Nedenlerini açıklayınız.
Cevap: Nötr özellikteki temizlik ürünleri tercih edilmelidir. Çünkü asidik veya bazik temizlik ürünleri doğal taşın yapısındaki kimyasal bileşenlerle tepkimeye girerek aşınmaya ve kalıcı renk değişikliklerine neden olabilir. Bu nedenle yüzey temizleyicileri gibi nötr ürünler, hassas yüzeylerin korunmasında daha etkilidir.
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 96-97
15. Soru: 2000-2004 yılları arasındaki kaza sayısının az olma sebebini nasıl açıklayabilirsiniz?
Cevap: 2000 yılı eğitim programında laboratuvar uygulamalarına çok az yer verilmiştir. Uygulamalı derslerin azlığı nedeniyle laboratuvar kullanımının sınırlı kalması, kazaların düşük sayıda olmasını sağlamıştır.
16. Soru: İlköğretim ikinci kademedeki öğrencilerin birinci kademedeki öğrencilerden daha fazla kaza yapma nedenleri neler olabilir?
Cevap: 2005 yılında eğitim programında yapılandırmacı yaklaşıma geçilmesiyle, ilköğretim ikinci kademede bağımsız araştırma-sorgulama yöntemleri teşvik edilmiştir. Bu dönemde öğrencilerin deneylere daha fazla katılım sağlaması ve sorumluluklarının artması, kazaların da artmasına yol açmıştır.
17. Soru: Lise ve üniversite düzeyinde kazaların az olmasının nedeni ne olabilir?
Cevap: Üniversite düzeyinde laboratuvar güvenliği hakkında akademisyenlerin donanımlı olması ve sıkı kuralların uygulanması kazaların azalmasını sağlamıştır. Ayrıca, lise ve üniversite seviyesindeki öğrencilerin daha bilinçli olması ve deney yapma konusunda tecrübelerinin artması da kazaları azaltan faktörlerdendir.
18. Soru: Bu laboratuvar kazalarına hangi güvenlik kurallarının ihlal edilmesi neden olabilir?
- 29.11.2005: Öğrenciler deney esnasında buhara maruz kalmış ve çeker ocak kullanmamıştır.
- 09.10.2006: Kullanılan deney malzemelerinin kalitesiz olması kazaya sebep olmuştur.
- 14.12.2006, 29.12.2010, 07.03.2012, 30.05.2012 ve 14.02.2013: Kimyasallarla çalışırken uyulması gereken kuralların ihlal edilmesi kazalara yol açmıştır.
19. Soru: Değişen öğretim programları ile laboratuvar kazaları arasında nasıl bir ilişki bulunmaktadır?
Cevap: 2005’ten itibaren laboratuvar uygulamalarının artmasıyla kazalarda da artış yaşanmıştır. Bu durum, okullarda güvenlik kurallarına dair farkındalığın yetersiz olduğunu ve öğretmen ile öğrencilerin bilinçsiz davrandığını göstermektedir.
20. Soru: İlköğretimin ikinci kademesinde 2013-2016 yıllarında yaşanan kazaların lise ve birinci kademe seviyesinden fazla olmasının sebebi ne olabilir?
Cevap: 2013 yılına kadar yaşanan cıva kaynaklı kazalardan sonra Türkiye genelindeki okullarda yeni düzenlemeler yapılmıştır. Bu düzenlemeler, cıva kullanımının azaltılması gibi önlemlerle kaza sayısında düşüşe neden olmuştur.
21. Soru: Kazaların önlenmesi için çözüm önerileriniz nelerdir?
- Laboratuvar güvenlik eğitimi zorunlu hale getirilmelidir.
- Deneylerde koruyucu ekipmanların kullanımı teşvik edilmelidir.
- Çeker ocak gibi güvenlik ekipmanlarının kullanımı artırılmalıdır.
- Kimyasalların doğru depolanması ve etiketlenmesi sağlanmalıdır.
- Öğretmenler ve laboratuvar sorumluları sürekli eğitimlerle bilinçlendirilmelidir.
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 98-99
22-25. soruları aşağıdaki bilgilere göre cevaplayınız.
22. Soru: Sodyumun valans elektronunu üst enerji seviyesine taşımak için gereken ışınlar
a) Şekilleri arasında nasıl bir fark vardır? Bu farkın ışınların enerjileri ile nasıl bir ilişkisi bulunmaktadır?
Sodyumun valans elektronunu üst enerji seviyesine taşımak için kullanılan ışınlar arasında, ışınların kıvrım sayısı farklılık gösterir. Enerji seviyesi arttıkça, ışınların dalga boyları kısalır ve kıvrımları artar. Böylece ışınlar daha yüksek enerji taşır.
b) Enerjileri arasındaki farkın sebebini açıklayan bir önerme yazınız.
Bir atomun enerji seviyesi yükseldikçe, enerji seviyeleri arasındaki fark da büyür. Elektronların daha üst seviyelere çıkması için gereken enerji artar, çünkü her enerji seviyesi daha fazla enerji gerektirir.
23. Soru: Sodyum atomunda aynı enerji seviyesindeki orbitallerde elektron geçişini sağlayan ışınların enerjileri arasında nasıl bir fark vardır? Bu farkın sebebini açıklayan bir önerme yazınız.
Sodyum atomunda, 3s orbitalinden 3d orbitaline geçiş için gereken enerji, 3p orbitaline geçişten daha büyüktür. Bu, orbitallerin enerji seviyelerinin farklı olmasından kaynaklanır; 3d orbitali daha yüksek enerji gerektirir.
24. Soru: İkinci ekran görüntüsündeki verilerden ulaşabileceğiniz ifadeleri işaretleyiniz.
- 5s orbitalinin enerjisi, 4s orbitalinin enerjisinden fazladır.
- Sodyum valans elektronunun 6s orbitaline geçmek için gereken enerji, 5s orbitaline geçmekten daha fazladır.
- 3d orbitaline uyarlanmış valans elektronu, 3s orbitaline geçiş yaptığında ışının rengi sarı veya mor olabilir.
25. Soru: Aşağıdaki ekran görüntüsünde orbitallerde elektronların bulunma olasılığını gösteren grafikler verilmiştir. Grafiklerdeki eğrilerin her biri tablolardaki bir orbitale aittir. Grafik 1’deki eğrilerde tepe sayısı arttıkça orbitalin enerjisi artmakta, Grafik 2’deki eğrilerde tepe sayısı arttıkça orbitalin enerjisi azalmaktadır.
Grafiklerde gösterilen eğriler, orbitallerde elektronların bulunma olasılıklarını göstermektedir. Grafik 1'de, 3s orbitalinden 4s ve 5s orbitallerine geçiş için gereken enerji artar. Grafik 2'de ise tepe noktalarının azalması, enerji gereksiniminin arttığını ve orbitallerde elektron bulunma olasılığının azaldığını gösterir.
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 100
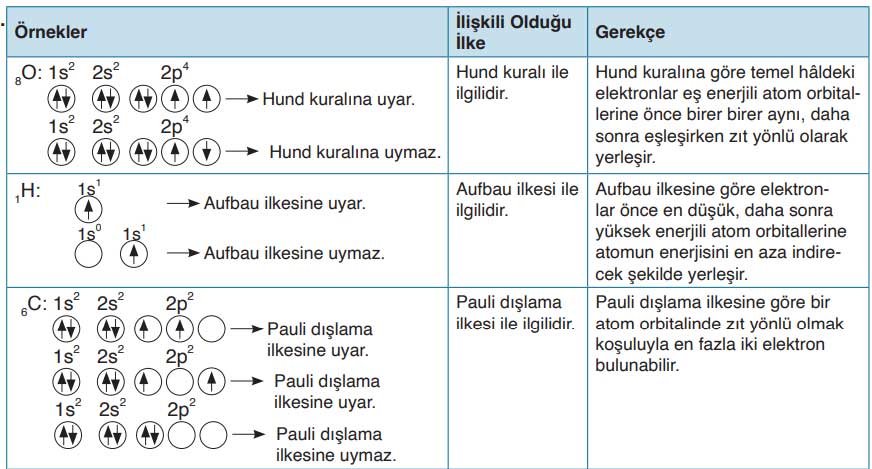
26. Aşağıdaki tabloda Aufbau ve Pauli ilkeleriyle Hund kuralını bulabilmeniz için örnekler verilmiştir. Tablodaki ilgili bölüme en az iki örnek ekleyerek boşlukları doldurunuz. (Elementlerin sembolleri ve atom numaraları için periyodik tabloyu kullanınız.)
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 101
27-31. soruları aşağıda verilen metin ve periyodik tabloya göre cevaplayınız.
27. Soru: Eren’in geliştirdiği yazılım programında kullandığı kod doğru mudur? Nedenlerinizi açıklayınız.
Cevap: Eren'in yazılımında kullandığı kod doğru değildir. Örneğin:
- N atomu 2. periyot, 5A grubunda yer almalıdır.
- Al atomu 3. periyot, 3A grubunda, Ar atomu 3. periyot, 8A grubunda olmalıdır.
- Mn atomu 4. periyot, 7B grubunda bulunmalıdır.
28. Soru: Eren’in elementlerin periyot numarasını belirlemek için kullandığı kod örüntüsü nedir?
Cevap: Eren, periyot numarasını belirlerken elektron diziliminde yazılan en son orbital türünün katsayısını kullanmıştır.
Örnek:
- N: 1s² 2s² 2p³ → 2. periyot
- Mn: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁵ → 4. periyot
- Ni: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁸ → 4. periyot
29. Soru: Elementlerin periyot numarasını belirlemeye yönelik doğru örüntünün oluşturulabileceği üç örnek yazınız.
- Cl: 1s² 2s² 2p⁶ 3s² 3p⁵ → 3. periyot
- Ni: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁸ → 4. periyot
- As: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p³ → 4. periyot
30. Soru: Eren’in elementlerin grup numarasını belirlemek için kullandığı kod örüntüsü nedir?
Cevap: Eren, elektron diziliminde en son orbital türündeki elektronları dikkate alarak grupları belirlemiştir. Tüm elementleri A grubu olarak değerlendirmiştir.
Örnek:
- As: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p³ → 3A grubu
- Mn: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁵ → 5A grubu
31. Soru: Elementlerin grup numarasını belirlemeye yönelik doğru örüntünün oluşturulabileceği üç örnek yazınız.
- O: 1s² 2s² 2p⁴ → 6A grubu
- Ge: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹⁰ 4p² → 4A grubu
- Fe: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶ → 8B grubu
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 102-103
32-33. soruları aşağıda verilen metin ve tabloya göre cevaplayınız.
32. Tabloya göre iyon oluşumuna yönelik oluşturulan aşağıdaki örüntüler doğru ise “Doğru”, yanlış ise “Yanlış” seçeneğini işaretleyiniz.
a) Soru: X ve Y atomlarının iyon oluşum sürecinde elektron sayısı artmıştır.
Yanıt: Yanlış
Nedeni: X ve Y atomları iyonlaşırken elektron kaybeder, bu yüzden elektron sayısı artmaz, aksine azalır.
b) Soru: Z ve T atomlarının iyon oluşum sürecinde elektron sayısı azalmıştır.
Yanıt: Yanlış
Nedeni: Z ve T atomları iyonlaşırken elektron kazanır, bu yüzden elektron sayısı azalmaz, artar.
c) Soru: Kation oluşumunda en yüksek enerji düzeyindeki orbitalden elektronlar verilmiştir.
Yanıt: Doğru
Nedeni: Kation oluşumunda en dış enerji seviyesindeki elektronlar ilk olarak kaybedilir.
ç) Soru: X⁺, Y²⁺, Z⁻ ve T⁻ iyonlarının elektron dizilimleri soy gazların elektron dizilimine benzemektedir.
Yanıt: Doğru
Nedeni: İyonlar kararlı yapıya ulaşmak için soy gazların elektron dizilimine benzer şekilde elektron kazanır veya kaybeder.
d) Soru: X ve Y atomları elektron verdiği için + ile yüklenmiştir.
Yanıt: Doğru
Nedeni: Elektron kaybı sonucu pozitif yük kazanılır ve kation oluşur.
e) Soru: Z ve T atomları elektron aldığı için - ile yüklenmiştir.
Yanıt: Doğru
Nedeni: Elektron kazanan atomlar negatif yük kazanarak anyon haline gelir.
f) Soru: X⁺, Y²⁺, Z⁻ ve T⁻ iyonlarının her birinin proton ve elektron sayısı arasındaki fark ile iyon yükü eşittir.
Yanıt: Doğru
Nedeni: İyon yükü, proton ve elektron arasındaki fark kadar olur.
g) Soru: X⁺, Y²⁺, Z⁻ ve T⁻ iyonlarının her birinin proton ve elektron sayısı arasındaki fark ile iyon yükü eşittir.
Yanıt: Doğru
Nedeni: İyonların yükü, proton ve elektron sayıları arasındaki fark kadar belirlenir.
33. Aşağıdaki reaksiyonlarda ve kutularda bulunan boşlukları örnekteki gibi doldurunuz. Her reaksiyonun altına taneciklerdeki değişimi ifade eden en az bir tane genelleme yazınız.

9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 104
34-38. soruları aşağıdaki metne ve grafiklere göre cevaplayınız.
34. Soru: Lityumun PES grafiğinde hangi tepe noktası valans elektronlarına aittir? Gerekçeleriyle açıklayınız.
Cevap: Elektronların bağlanma enerjisi, çekirdeğe olan uzaklıklarına göre değişir. Çekirdeğe yakın elektronlar daha güçlü çekilir ve bağlanma enerjileri yüksektir. Valans elektronları daha uzakta yer aldığı için bağlanma enerjisi daha düşüktür. Lityumun PES grafiğinde valans elektronlarının bağlanma enerjisi 0,52 eV olarak görülmektedir.
35. Soru: Grafiklerdeki verileri kullanarak X, Y ve Z atomlarının elektron dağılımlarını yazınız ve bu atomların hangi elemente ait olduğunu belirtiniz.
Cevap:
- Li: 1s² 2s¹
- Na: 1s² 2s² 2p⁶ 3s¹
- Mg: 1s² 2s² 2p⁶ 3s²
- Al: 1s² 2s² 2p⁶ 3s² 3p¹
36. Soru: X atomunun valans elektronlarının bağlanma enerjisi ile lityum atomunun valans elektronlarının bağlanma enerjisi arasındaki farkın sebebini açıklayınız.
Cevap: X atomu sodyumdur. Sodyumun valans elektronları 3s orbitalinde yer alır ve lityumunkilere göre çekirdekten daha uzaktır. Bu yüzden sodyumun valans elektronlarının bağlanma enerjisi, lityumunkine göre daha düşüktür.
37. Soru: X, Y ve Z atomlarının en son kabuktaki elektronlarının bağlanma enerjileri arasındaki farkın sebebini açıklayınız.
Cevap: Elektron koparma enerjisi, bir elektronun atomdan uzaklaştırılması için gereken enerjiyi ifade eder. Periyodik tabloda soldan sağa gidildikçe atom yarıçapı küçülür ve elektron koparmak için gereken enerji artar. Alüminyumda son kabuktaki elektronun koparılması için en fazla enerji gerekmektedir. Magnezyumda ise bu enerji daha düşük olup, bu durum atomun simetrik yapısından kaynaklanmaktadır.
38. Soru: X, Y ve Z atomlarının çekirdeğe en yakın kabuktaki bağlanma enerjilerinin farkını açıklayınız.
Cevap: Na, Mg ve Al atomlarında çekirdeğe yakın elektronlar, çekirdek tarafından daha güçlü çekilir. Alüminyum atomunun çekirdek yükü daha fazla olduğu için, çekirdeğe yakın elektronların bağlanma enerjisi de daha yüksektir.
9. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 105
39-40. soruları aşağıdaki bilgilere göre cevaplayınız
39. Orbital, yörünge ve atom yapısındaki kavramların gelişimi hakkında açıklama yapınız.
Dalton atom teorisi, atomları içi dolu küreler olarak tanımlamıştır. Thomson atom modeli, atomun içinde pozitif ve negatif yüklü taneciklerin bulunduğunu göstermiştir. Rutherford atom modeli, protonların merkezde bir çekirdek oluşturduğunu ve elektronların rastgele hareket ettiğini belirtmiştir. Bohr modeli, elektronların belirli yörüngelerde döndüğünü ifade ederken, modern atom teorisi elektronların olasılık bölgelerinde bulunduğunu savunur. Bu gelişmeler, atom yapısına dair anlayışın zamanla nasıl değiştiğini göstermektedir.
40. Helium atomunun kütlesinin hesaplanmasında teorik gelişmelerin etkisi nedir?
Dalton atom teorisi, atom altı parçacıklardan bahsetmediği için helium kütlesi hesaplanamamıştır. Thomson modelinde protonlar tanımlansa da kütlesine dair veri eksikti. Rutherford modeli proton kütlesini belirledi. Modern teoriyle birlikte neutronlar da hesaba katılarak heliumun kütlesi daha hassas şekilde ölçülmüştür. Bu süreç, bilimin zamanla gelişen yapısını ve bilgiye dayalı değişimleri yansıtır.







Türkçe karakter kullanılmayan ve büyük harflerle yazılmış yorumlar onaylanmamaktadır.